
- Συγγραφέας Miles Stephen [email protected].
- Public 2023-12-15 23:35.
- Τελευταία τροποποίηση 2025-01-22 16:57.
ο μέση ατομική μάζα ενός στοιχείου είναι το άθροισμα των μάζες των ισοτόπων του, το καθένα πολλαπλασιασμένο με τη φυσική του αφθονία (το δεκαδικό που σχετίζεται με το ποσοστό του άτομα από αυτό στοιχείο που είναι δεδομένου ισοτόπου). Μέση ατομική μάζα = στ1Μ1 + στ2Μ2 +…
Στη συνέχεια, μπορεί επίσης να αναρωτηθεί κανείς, πώς υπολογίζεται η ατομική μάζα ενός στοιχείου;
Προς το υπολογίζω ο ατομική μάζα ενός single άτομο ενός στοιχείο , προσθέστε το μάζα των πρωτονίων και των νετρονίων. Παράδειγμα: Βρείτε το ατομική μάζα ενός ισοτόπου άνθρακα που έχει 7 νετρόνια. Μπορείτε να δείτε από τον περιοδικό πίνακα ότι ο άνθρακας έχει ένα ατομικός αριθμός 6, που είναι ο αριθμός των πρωτονίων του.
Επιπλέον, η ατομική μάζα είναι ίδια με το ατομικό βάρος; Ατομική μάζα (Μένα) είναι το μάζα ενός άτομο . Ενα μονό άτομο έχει έναν καθορισμένο αριθμό πρωτονίων και νετρονίων, οπότε το μάζα είναι μονοσήμαντο (δεν θα αλλάξει) και είναι το άθροισμα του αριθμού των πρωτονίων και των νετρονίων στο άτομο . Ατομικό βάρος είναι ένας σταθμισμένος μέσος όρος του μάζα όλων των άτομα ενός στοιχείου, με βάση την αφθονία των ισοτόπων.
Με αυτόν τον τρόπο, πώς υπολογίζετε τη μέση ατομική μάζα του άνθρακα;
Προς το εύρημα ο μέση ατομική μάζα , παίρνετε έναν ορισμένο αριθμό άτομα , εύρημα Η συνολική μάζα κάθε ισοτόπου και μετά διαιρέστε το σύνολο μάζα όλων των άτομα από τον συνολικό αριθμό των άτομα . Ας υποθέσουμε ότι έχετε, ας πούμε, 10 000 άτομα του άνθρακας . Τότε έχετε 9893 άτομα των 12C και 107 άτομα των 13 C.
Ποια είναι η μέση ατομική μάζα τιτανίου στον πλανήτη;
Ισότοπο: 46Ti Αφθονία: 75,200% Μάζα : 45,95263 Ισότοπο Amu: 48Ti Αφθονία: 12,300% Μάζα : 47,94795 Ισότοπο Amu: 50 Ti Αφθονία: 12,500% Μάζα : 49.94479 Amu.
Συνιστάται:
Πώς υπολογίζετε τη μέση ατομική μάζα του στροντίου;
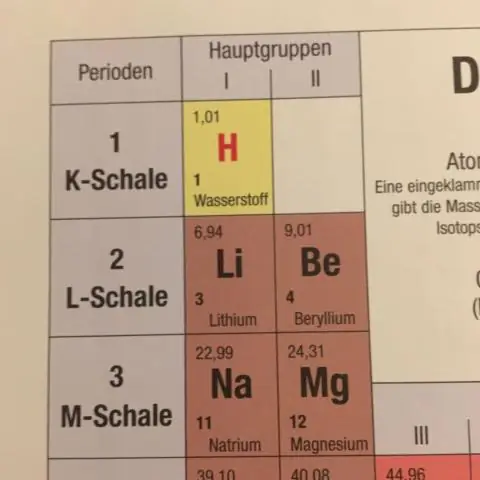
Έτσι, το υπολογίζουμε παίρνοντας τη σταθμισμένη μάζα καθενός από τα ισότοπα και προσθέτοντάς τα μαζί. Έτσι, για την πρώτη μάζα, θα πολλαπλασιάσουμε το 0,50% του 84 (amu - μονάδες ατομικής μάζας) = 0,042 amu, και θα το προσθέσουμε στο 9,9% του 86 amu = 8,51 amu, και ούτω καθεξής
Ποια είναι η διαφορά μεταξύ ενός ultramafic, ενός mafic, ενός intermediate και ενός felsic rock;

Σε ένα ευρέως αποδεκτό σύστημα ταξινόμησης περιεκτικότητας σε πυρίτιο, τα πετρώματα με περισσότερο από 65 τοις εκατό πυρίτιο ονομάζονται felsic. Αυτά με μεταξύ 55 και 65 τοις εκατό πυρίτιο είναι ενδιάμεσα. Αυτά με μεταξύ 45 και 55 τοις εκατό πυρίτιο είναι μαφικά. και εκείνοι με λιγότερο από 45 τοις εκατό είναι υπερμαφικοί
Πώς προσδιορίζεται η μέση ατομική μάζα που εμφανίζεται στον περιοδικό πίνακα;
Η μέση ατομική μάζα για ένα στοιχείο υπολογίζεται αθροίζοντας τις μάζες των ισοτόπων του στοιχείου, το καθένα πολλαπλασιαζόμενο με τη φυσική του αφθονία στη Γη. Όταν κάνετε οποιουσδήποτε υπολογισμούς μάζας που αφορούν στοιχεία ή ενώσεις, χρησιμοποιείτε πάντα τη μέση ατομική μάζα, η οποία μπορεί να βρεθεί στον περιοδικό πίνακα
Ποια είναι η σταθμισμένη μέση μάζα;

Η ατομική μάζα ενός στοιχείου είναι ο σταθμισμένος μέσος όρος των μαζών των ισοτόπων ενός στοιχείου. Η ατομική μάζα ενός στοιχείου μπορεί να υπολογιστεί με την προϋπόθεση ότι είναι γνωστές οι σχετικές αφθονίες των φυσικών ισοτόπων του στοιχείου και οι μάζες αυτών των ισοτόπων
Ποια είναι η μάζα σε γραμμάρια ενός μόνο ατόμου HG;

Α) Το ατομικό βάρος του υδραργύρου είναι 200,59, και έτσι 1 mol Hg ζυγίζει 200,59 g. Η μοριακή μάζα είναι αριθμητικά ίδια με το ατομικό ορμοριακό βάρος, αλλά έχει μονάδες γραμμαρίων permole
