- Συγγραφέας Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Τελευταία τροποποίηση 2025-01-22 16:57.
Εμείς λοιπόν υπολογίζω το λαμβάνοντας το σταθμισμένο μάζα καθενός από τα ισότοπα και προσθέτοντάς τα μαζί. Έτσι, για το πρώτο μάζα , θα πολλαπλασιάσουμε το 0,50% του 84 (amu - ατομική μάζα μονάδες) = 0,042 amu, και προσθέστε το στο 9,9% του 86 amu = 8,51 amu, και ούτω καθεξής.
Στη συνέχεια, μπορεί να ρωτήσει κανείς, πώς υπολογίζετε τη μέση ατομική μάζα;
Υπολογισμός της μέσης ατομικής μάζας ο μέση ατομική μάζα ενός στοιχείου είναι το άθροισμα των μάζες των ισοτόπων του, το καθένα πολλαπλασιασμένο με τη φυσική του αφθονία (το δεκαδικό που σχετίζεται με το ποσοστό του άτομα του στοιχείου που είναι ενός δεδομένου ισοτόπου). Μέση ατομική μάζα = στ1Μ1 + στ2Μ2 +…
Γνωρίζετε επίσης, ποιοι τρεις τύποι πληροφοριών χρειάζονται για τον υπολογισμό μιας μέσης ατομικής μάζας; Ο αριθμός των ισοτόπων που υπάρχουν για το στοιχείο. ο Ατομικός Αριθμός για το στοιχείο. Η ποσοστιαία αφθονία κάθε ισοτόπου.
Μπορεί επίσης να ρωτήσει κανείς, ποια τιμή είναι η πλησιέστερη στην ατομική μάζα του στροντίου;
Στρόντιο . Στην έκθεσή της του 1961, η Επιτροπή συνέστησε τον Αr(Sr) = 87,62 με βάση το μάζα -φασματομετρικός προσδιορισμός του Nier. Αυτό αξία αναθεωρήθηκε σε Αr(Sr) = 87,62(1) το 1969 και παραμένει αμετάβλητο έκτοτε.
Τι έχει μάζα 1 amu;
Μια μονάδα ατομικής μάζας (που συμβολίζεται AMU ή amu) ορίζεται ακριβώς ως το 1/12 της μάζας ενός ατόμου άνθρακα-12. Το άτομο άνθρακα-12 (C-12) έχει έξι πρωτόνια και έξι νετρόνια στον πυρήνα του. Σε ανακριβείς όρους, ένα AMU είναι ο μέσος όρος του πρωτόνιο μάζα ανάπαυσης και η νετρόνιο μάζα ανάπαυσης.
Συνιστάται:
Ποια είναι η μέση ατομική μάζα ενός ατόμου;

Η μέση ατομική μάζα ενός στοιχείου είναι το άθροισμα των μαζών των ισοτόπων του, το καθένα πολλαπλασιαζόμενο με τη φυσική του αφθονία (το δεκαδικό που σχετίζεται με το ποσοστό των ατόμων αυτού του στοιχείου που ανήκουν σε ένα δεδομένο ισότοπο). Μέση ατομική μάζα = f1M1 + f2M2 +
Ποιο είναι το χρώμα της φλόγας του στροντίου;

Δοκιμές φλόγας Χρώμα στοιχείου κόκκινο ρουβίδιο (κόκκινο-ιώδες) καισίου μπλε/ιώδες (βλ. παρακάτω) Ασβέστιο πορτοκαλί-κόκκινο στρόντιο κόκκινο
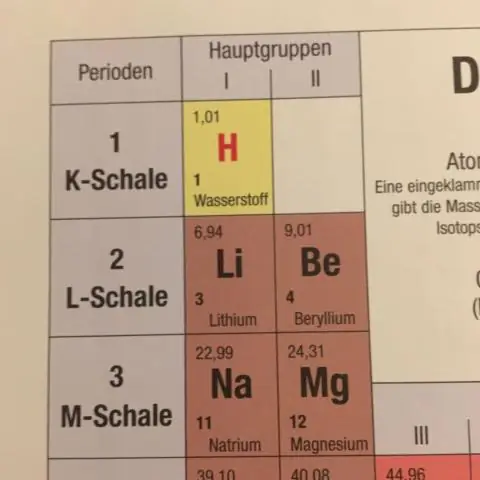
Πώς προσδιορίζεται η μέση ατομική μάζα που εμφανίζεται στον περιοδικό πίνακα;
Η μέση ατομική μάζα για ένα στοιχείο υπολογίζεται αθροίζοντας τις μάζες των ισοτόπων του στοιχείου, το καθένα πολλαπλασιαζόμενο με τη φυσική του αφθονία στη Γη. Όταν κάνετε οποιουσδήποτε υπολογισμούς μάζας που αφορούν στοιχεία ή ενώσεις, χρησιμοποιείτε πάντα τη μέση ατομική μάζα, η οποία μπορεί να βρεθεί στον περιοδικό πίνακα
Έχουν όλα τα άτομα του μαγνησίου την ίδια ατομική μάζα;

Α: Το μαγνήσιο, στη στοιχειακή του μορφή, έχει 12 πρωτόνια και 12 ηλεκτρόνια. Τα νετρόνια είναι άλλο θέμα. Η μέση ατομική μάζα του μαγνησίου είναι 24.305 μονάδες ατομικής μάζας, αλλά κανένα άτομο μαγνησίου δεν έχει ακριβώς αυτή τη μάζα
Πώς υπολογίζετε την ατομική μάζα του βορίου;
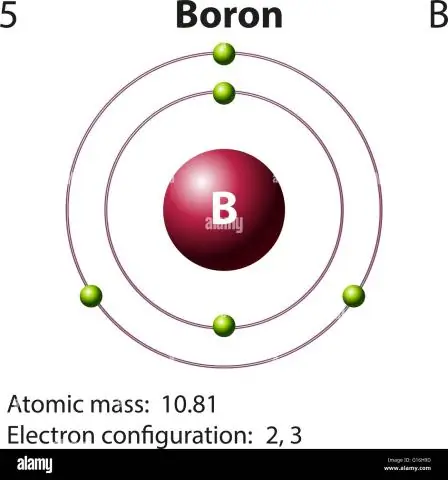
Για το βόριο, αυτή η εξίσωση θα μοιάζει με αυτό: 5 πρωτόνια + 5 νετρόνια = 10 μονάδες ατομικής μάζας (AMU) ή, για το πιο συχνά απαντώμενο ισότοπο βορίου (περίπου 5 πρωτόνια + 6 νετρόνια = 11 AMU
