Πίνακας περιεχομένων:
- Συγγραφέας Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Τελευταία τροποποίηση 2025-01-22 16:57.
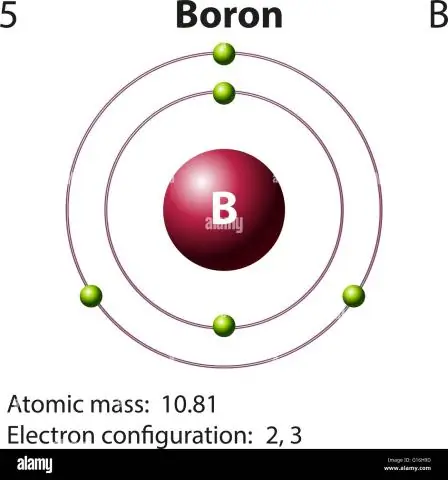
Για το βόριο, αυτή η εξίσωση θα μοιάζει με αυτό:
- 5 πρωτόνια + 5 νετρόνια = 10 ατομική μάζα μονάδες (AMU) ή, για τις πιο συχνές βόριο ισότοπο (περ.
- 5 πρωτόνια + 6 νετρόνια = 11 AMU.
Λαμβάνοντας αυτό υπόψη, ποια είναι η ατομική μάζα του βορίου;
10.811 u
Επίσης, πώς υπολογίζεις την ατομική μάζα του νέον; 20,1797 u
Οι άνθρωποι ρωτούν επίσης, πώς υπολογίζετε την ατομική μάζα;
Προς το υπολογίστε την ατομική μάζα ενός single άτομο ενός στοιχείου, αθροίστε το μάζα των πρωτονίων και των νετρονίων. Παράδειγμα: Βρείτε το ατομική μάζα ενός ισοτόπου άνθρακα που έχει 7 νετρόνια. Μπορείτε να δείτε από τον περιοδικό πίνακα ότι ο άνθρακας έχει ένα ατομικός αριθμός 6, που είναι ο αριθμός των πρωτονίων του.
Τι έχει μάζα 1 amu;
Μια μονάδα ατομικής μάζας (που συμβολίζεται AMU ή amu) ορίζεται ως ακριβώς το 1/12 της μάζας ενός ατόμου άνθρακα-12. Το άτομο άνθρακα-12 (C-12) έχει έξι πρωτόνια και έξι νετρόνια στον πυρήνα του. Σε ανακριβείς όρους, ένα AMU είναι ο μέσος όρος του πρωτόνιο μάζα ανάπαυσης και η νετρόνιο μάζα ανάπαυσης.
Συνιστάται:
Πώς υπολογίζετε τη μέση ατομική μάζα του στροντίου;

Έτσι, το υπολογίζουμε παίρνοντας τη σταθμισμένη μάζα καθενός από τα ισότοπα και προσθέτοντάς τα μαζί. Έτσι, για την πρώτη μάζα, θα πολλαπλασιάσουμε το 0,50% του 84 (amu - μονάδες ατομικής μάζας) = 0,042 amu, και θα το προσθέσουμε στο 9,9% του 86 amu = 8,51 amu, και ούτω καθεξής
Πώς προσδιορίζεται η μέση ατομική μάζα που εμφανίζεται στον περιοδικό πίνακα;

Η μέση ατομική μάζα για ένα στοιχείο υπολογίζεται αθροίζοντας τις μάζες των ισοτόπων του στοιχείου, το καθένα πολλαπλασιαζόμενο με τη φυσική του αφθονία στη Γη. Όταν κάνετε οποιουσδήποτε υπολογισμούς μάζας που αφορούν στοιχεία ή ενώσεις, χρησιμοποιείτε πάντα τη μέση ατομική μάζα, η οποία μπορεί να βρεθεί στον περιοδικό πίνακα
Έχουν όλα τα άτομα του μαγνησίου την ίδια ατομική μάζα;

Α: Το μαγνήσιο, στη στοιχειακή του μορφή, έχει 12 πρωτόνια και 12 ηλεκτρόνια. Τα νετρόνια είναι άλλο θέμα. Η μέση ατομική μάζα του μαγνησίου είναι 24.305 μονάδες ατομικής μάζας, αλλά κανένα άτομο μαγνησίου δεν έχει ακριβώς αυτή τη μάζα
Πώς ανακάλυψε ο Τζέιμς Τσάντγουικ την ατομική του θεωρία;

Το 1932, ο James Chadwick βομβάρδισε άτομα βηρυλλίου με σωματίδια άλφα. Παρήχθη μια άγνωστη ακτινοβολία. Ο Chadwick ερμήνευσε αυτή την ακτινοβολία ως αποτελούμενη από σωματίδια με ουδέτερο ηλεκτρικό φορτίο και την κατά προσέγγιση μάζα ενός πρωτονίου. Αυτό το σωματίδιο έγινε γνωστό ως νετρόνιο
Πώς βρίσκετε την ατομική ακτίνα του PM;

Οι ατομικές ακτίνες έχουν μετρηθεί για στοιχεία. Οι μονάδες για τις ατομικές ακτίνες είναι πικόμετρα, ίσες με 10&μείον;12 μέτρα. Για παράδειγμα, η διαπυρηνική απόσταση μεταξύ των δύο ατόμων υδρογόνου σε ένα μόριο Η2 μετράται ότι είναι 74 pm. Επομένως, η ατομική ακτίνα ενός ατόμου υδρογόνου είναι 742=37 pm 74 2 = 37 pm
