
Πίνακας περιεχομένων:
- Συγγραφέας Miles Stephen [email protected].
- Public 2024-01-18 08:14.
- Τελευταία τροποποίηση 2025-01-22 16:57.
Ορισμός pH και pOH
- Πριν συζητήσουμε το pH πρέπει να κατανοήσουμε τη συμπεριφορά ισορροπίας του νερού.
- Kw = [H3O+][OH-] = [H+][OH-] = 1,001x10-14 (στους 25 oC, Kw εξαρτάται από τη θερμοκρασία)
- Σε καθαρό νερό [H+] = [OH-] = 1,00x10-7 M.
- Το pH είναι μια συντομογραφία για -log[H+] και η pOH είναι μια συντομογραφία για -log[OH-].
Επιπλέον, ποιος είναι ο τύπος για τα kW στη χημεία;
Αυτή η σταθερά, Kw , ονομάζεται σταθερά αυτοπρωτόλυσης νερού ή σταθερά αυτοιονισμού νερού. (Μερικές φορές το πρόθεμα auto απορρίπτεται, όπως έγινε στον τίτλο αυτής της ενότητας.) Μπορεί να προσδιοριστεί με πείραμα και έχει την τιμή 1,011 x 10¯14 στους 25 °C. Γενικά, χρησιμοποιείται μια τιμή 1,0 x 10¯14.
Ομοίως, ποια είναι η τιμή των kW στα 25 _firxam_#8728; ΝΤΟ? ο τιμή Kw στα 25 βαθμούς Κελσίου είναι συγκεκριμένα 1×10−14 1 × 10 − 14. Kw είναι ένα παράδειγμα σταθεράς ισορροπίας.
Έτσι ακριβώς, με τι ισούται με kW;
Η κιλοβατώρα είναι μια σύνθετη μονάδα ενέργειας ίσο με ένα κιλοβάτ ( kW ) ισχύος που διατηρήθηκε για μία ώρα. Εκφρασμένο στην τυπική μονάδα ενέργειας στο Διεθνές Σύστημα Μονάδων (SI), το τζάουλ (σύμβολο J), είναι ίσο με 3600 kilojoules (3,6 MJ).
Τι είναι η σταθερά ιονισμού;
Ιατρικός ορισμός του σταθερά ιοντισμού : ένα συνεχής Αυτό εξαρτάται από την ισορροπία μεταξύ των ιόντων και των μορίων που δεν είναι ιονισμένο σε διάλυμα ή υγρό -σύμβολο Κ. - που ονομάζεται επίσης σταθερά διάστασης.
Συνιστάται:
Πώς λειτουργούν οι δεσμοί στη χημεία;
Ένας χημικός δεσμός είναι μια διαρκής έλξη μεταξύ ατόμων, ιόντων ή μορίων που επιτρέπει το σχηματισμό χημικών ενώσεων. Ο δεσμός μπορεί να προκύψει από την ηλεκτροστατική δύναμη έλξης μεταξύ αντίθετα φορτισμένων ιόντων όπως στους ιοντικούς δεσμούς ή μέσω της κοινής χρήσης ηλεκτρονίων όπως στους ομοιοπολικούς δεσμούς
Πώς χρησιμοποιείτε την αρχή Aufbau στη χημεία;

Η αρχή του Aufbau περιγράφει τους κανόνες που χρησιμοποιούνται για τον προσδιορισμό του τρόπου με τον οποίο τα ηλεκτρόνια οργανώνονται σε κελύφη και υποφλοιούς γύρω από τον ατομικό πυρήνα. Τα ηλεκτρόνια μπαίνουν στο υποκέλυφος έχοντας τη χαμηλότερη δυνατή ενέργεια. Ένα τροχιακό μπορεί να κρατήσει το πολύ 2 ηλεκτρόνια που υπακούουν στην αρχή αποκλεισμού Pauli
Πώς υπολογίζεται το EAN στη χημεία;

Γενικά το EAN του κεντρικού ιόντος μετάλλου θα είναι ίσο με τον αριθμό των ηλεκτρονίων στο πλησιέστερο ευγενές αέριο. Εάν το EAN του κεντρικού μετάλλου είναι ίσο με τον αριθμό της ηλεκτρονίνης του πλησιέστερου ευγενούς αερίου, τότε το σύμπλοκο έχει μεγαλύτερη σταθερότητα. EAN= [Z μέταλλο – (οξ. κατάσταση του μετάλλου) +2 (αριθμός συντονισμού του μετάλλου)]
Πώς υπολογίζετε τη μεταβολή της ενθαλπίας στη χημεία;

Χρησιμοποιήστε τον τύπο ∆H = m x s x ∆T για να λύσετε. Μόλις έχετε m, τη μάζα των αντιδρώντων σας, s, την ειδική θερμότητα του προϊόντος σας, και ΔT, τη μεταβολή της θερμοκρασίας από την αντίδρασή σας, είστε έτοιμοι να βρείτε την ενθαλπία της αντίδρασης. Απλώς συνδέστε τις τιμές σας στον τύπο ∆H = m x s x ∆T και πολλαπλασιάστε για να τις λύσετε
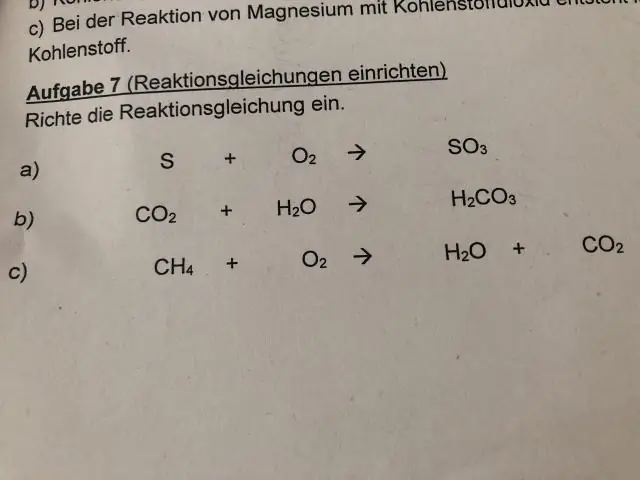
Πώς υπολογίζετε την αποσύνθεση στη χημεία;

Μια αντίδραση αποσύνθεσης συμβαίνει όταν ένα αντιδρών διασπάται σε δύο ή περισσότερα προϊόντα. Μπορεί να αναπαρασταθεί με τη γενική εξίσωση: AB → A + B. Σε αυτήν την εξίσωση, το AB αντιπροσωπεύει το αντιδρόν που ξεκινά την αντίδραση και το Α και το Β αντιπροσωπεύουν τα προϊόντα της αντίδρασης
