
- Συγγραφέας Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Τελευταία τροποποίηση 2025-06-01 05:04.
Γενικά EAN του κεντρικού ιόντος μετάλλου θα είναι ίσος με τον αριθμό των ηλεκτρονίων στο πλησιέστερο ευγενές αέριο. Αν το EAN του κεντρικού μετάλλου ισούται με τον αριθμό της ηλεκτρονίνης το πλησιέστερο ευγενές αέριο τότε το σύμπλοκο έχει μεγαλύτερη σταθερότητα. EAN = [Ζ μέταλλο - (οξ. κατάσταση του μετάλλου) +2(αριθμός συντονισμού του μετάλλου)].
Έχοντας αυτό υπόψη, τι σημαίνει ο κανόνας EAN;
…παρατήρηση, αφού είναι γνωστή ως η Κανόνας EAN , ότι σε έναν αριθμό μεταλλικών συμπλεγμάτων το άτομο μετάλλου τείνει να περιβάλλεται από επαρκείς συνδέτες που το προκύπτον αποτελεσματικός ατομικός αριθμός είναι αριθμητικά ίσος με τον ατομικό αριθμό του στοιχείου ευγενούς αερίου που βρέθηκε την ίδια περίοδο στην οποία το μέταλλο…
Ομοίως, τι είναι ο κανόνας των 18 ηλεκτρονίων με παράδειγμα; Σε αυτό παράδειγμα , η μοριακή ένωση έχει ένα 18 ηλεκτρόνια μετρήστε, που σημαίνει ότι όλα τα τροχιακά του είναι γεμάτα και η ένωση είναι σταθερή. Για να ικανοποιήσει το 18 ηλεκτρονικός κανόνας , η [Co(CO)5]z Η ένωση πρέπει να έχει φορτίο z = +1.
Επίσης, πρέπει να γνωρίζετε πώς βρίσκετε τον ενεργό ατομικό αριθμό;
Μαθηματικά, το αποτελεσματικός ατομικός αριθμός Ζεφ μπορεί να υπολογιστεί χρησιμοποιώντας μεθόδους που είναι γνωστές ως υπολογισμοί "αυτοσυνεπούς πεδίου", αλλά σε απλοποιημένες καταστάσεις λαμβάνεται ακριβώς ως ατομικός αριθμός μείον το αριθμός των ηλεκτρονίων μεταξύ του πυρήνα και του ηλεκτρονίου που εξετάζεται.
Ποιο δεν υπακούει στον κανόνα EAN;
ο EAN ( Πραγματικός ατομικός αριθμός ) είναι ισχύει για τα περισσότερα καρβονύλια. Ωστόσο, ορισμένα καρβονύλια όπως το V(CO)6 μην ακολούθησε το Κανόνας EAN . Τα ολικά ηλεκτρόνια γύρω από το κεντρικό άτομο μετάλλου (V) είναι 23+12 = 35, το οποίο δεν είναι ίσος με τον αριθμό των ηλεκτρονίων που περιβάλλουν το ευγενές αέριο, εξ ου και είναι παραβίαση του Κανόνας EAN.
Συνιστάται:
Πώς λειτουργούν οι δεσμοί στη χημεία;
Ένας χημικός δεσμός είναι μια διαρκής έλξη μεταξύ ατόμων, ιόντων ή μορίων που επιτρέπει το σχηματισμό χημικών ενώσεων. Ο δεσμός μπορεί να προκύψει από την ηλεκτροστατική δύναμη έλξης μεταξύ αντίθετα φορτισμένων ιόντων όπως στους ιοντικούς δεσμούς ή μέσω της κοινής χρήσης ηλεκτρονίων όπως στους ομοιοπολικούς δεσμούς
Πώς χρησιμοποιείτε την αρχή Aufbau στη χημεία;

Η αρχή του Aufbau περιγράφει τους κανόνες που χρησιμοποιούνται για τον προσδιορισμό του τρόπου με τον οποίο τα ηλεκτρόνια οργανώνονται σε κελύφη και υποφλοιούς γύρω από τον ατομικό πυρήνα. Τα ηλεκτρόνια μπαίνουν στο υποκέλυφος έχοντας τη χαμηλότερη δυνατή ενέργεια. Ένα τροχιακό μπορεί να κρατήσει το πολύ 2 ηλεκτρόνια που υπακούουν στην αρχή αποκλεισμού Pauli
Πώς υπολογίζεται το FC στη φυσική;

Η κεντρομόλος δύναμη μετριέται σε Newton και υπολογίζεται ως η μάζα (σε kg), πολλαπλασιαζόμενη με την εφαπτομενική ταχύτητα (σε μέτρα ανά δευτερόλεπτο) στο τετράγωνο, διαιρούμενη με την ακτίνα (σε μέτρα). Αυτό σημαίνει ότι αν η εφαπτομενική ταχύτητα διπλασιαστεί, η δύναμη θα τετραπλασιαστεί
Πώς υπολογίζετε τη μεταβολή της ενθαλπίας στη χημεία;

Χρησιμοποιήστε τον τύπο ∆H = m x s x ∆T για να λύσετε. Μόλις έχετε m, τη μάζα των αντιδρώντων σας, s, την ειδική θερμότητα του προϊόντος σας, και ΔT, τη μεταβολή της θερμοκρασίας από την αντίδρασή σας, είστε έτοιμοι να βρείτε την ενθαλπία της αντίδρασης. Απλώς συνδέστε τις τιμές σας στον τύπο ∆H = m x s x ∆T και πολλαπλασιάστε για να τις λύσετε
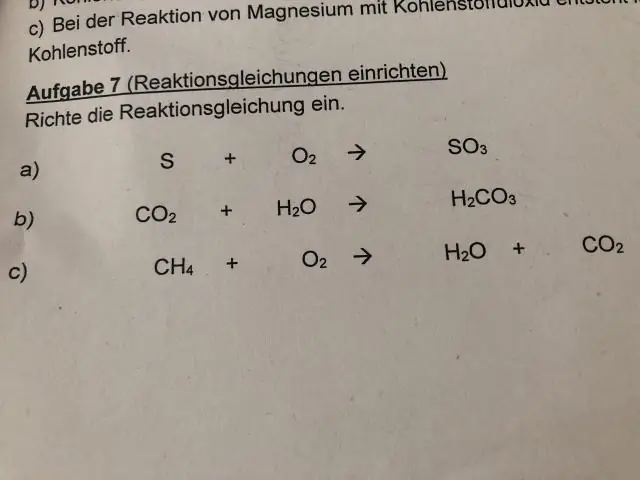
Πώς υπολογίζετε την αποσύνθεση στη χημεία;

Μια αντίδραση αποσύνθεσης συμβαίνει όταν ένα αντιδρών διασπάται σε δύο ή περισσότερα προϊόντα. Μπορεί να αναπαρασταθεί με τη γενική εξίσωση: AB → A + B. Σε αυτήν την εξίσωση, το AB αντιπροσωπεύει το αντιδρόν που ξεκινά την αντίδραση και το Α και το Β αντιπροσωπεύουν τα προϊόντα της αντίδρασης
