
- Συγγραφέας Miles Stephen [email protected].
- Public 2023-12-15 23:35.
- Τελευταία τροποποίηση 2025-01-22 16:57.
Αν χρειαστεί χρήση Αυτό εξίσωση , απλώς βρείτε το κουμπί "ln" στην αριθμομηχανή σας. Μπορείς χρησιμοποιήστε την εξίσωση Arrhenius για να δείξει την επίδραση μιας μεταβολής της θερμοκρασίας στη σταθερά του ρυθμού - άρα και στον ρυθμό της αντίδρασης. Αν η σταθερά ταχύτητας διπλασιαστεί, για παράδειγμα, θα διπλασιαστεί και η ταχύτητα της αντίδρασης.
Ομοίως, ποια είναι η φόρμουλα για την ενέργεια ενεργοποίησης;
Προσδιορισμός Ενέργειας Ενεργοποίησης. Παρατηρήστε ότι όταν η εξίσωση Arrhenius αναδιαταχθεί όπως παραπάνω είναι μια γραμμική εξίσωση με τη μορφή y = mx + b. Το y είναι ln(k), το x είναι 1/Τ και το m είναι -Eένα/R. Η ενέργεια ενεργοποίησης για την αντίδραση μπορεί να προσδιοριστεί με την εύρεση του κλίση της γραμμής.
Επιπλέον, ποιες είναι οι μονάδες για το Κ; Από το μοτίβο του μονάδες μπορούμε να πούμε ότι για μια αντίδραση κινητικής τάξης n, το μονάδες του κ είναι: κ = 1/tc^(n-1), έχοντας υπόψη ότι c είναι η ποσότητα ανά λίτρο εκφρασμένη σε μάζα ή μοριακότητα και n είναι η κινητική τάξη.
Τότε, ποιες είναι οι μονάδες ενέργειας ενεργοποίησης στην εξίσωση Arrhenius;
όπου το k αντιπροσωπεύει τη σταθερά του ρυθμού, Eένα είναι το ενέργεια ενεργοποίησης , R είναι η σταθερά αερίου (8,3145 J/K mol) και T είναι η θερμοκρασία που εκφράζεται σε Kelvin. Το Α είναι γνωστό ως ο παράγοντας συχνότητας, έχοντας μονάδες του L mol-1 μικρό-1, και λαμβάνει υπόψη τη συχνότητα των αντιδράσεων και την πιθανότητα σωστού μοριακού προσανατολισμού.
Ποια είναι η σταθερά ρυθμού k;
ο σταθερά ρυθμού , κ , είναι αναλογικότητα συνεχής που δείχνει τη σχέση μεταξύ της μοριακής συγκέντρωσης των αντιδρώντων και του τιμή μιας χημικής αντίδρασης. ο σταθερά ρυθμού μπορεί να βρεθεί πειραματικά, χρησιμοποιώντας τις μοριακές συγκεντρώσεις των αντιδρώντων και τη σειρά αντίδρασης.
Συνιστάται:
Πώς χρησιμοποιείτε την παλιά ζυγαριά;

Το άκρο της δοκού στο αριστερό άκρο της ζυγαριάς θα πρέπει να ανέρχεται στην κορυφή του πλαισίου της. Συνήθως θα χτυπήσει στην κορυφή με ένα ευδιάκριτο χτύπημα. Μετακινήστε το μεγάλο βάρος ολίσθησης προς τα δεξιά από εγκοπή σε εγκοπή. Το άκρο της δοκού, που προεξέχει στην αριστερή πλευρά της ζυγαριάς, θα χαμηλώνει καθώς μετακινείτε το βάρος
Πώς χρησιμοποιείτε την αρχή Aufbau στη χημεία;

Η αρχή του Aufbau περιγράφει τους κανόνες που χρησιμοποιούνται για τον προσδιορισμό του τρόπου με τον οποίο τα ηλεκτρόνια οργανώνονται σε κελύφη και υποφλοιούς γύρω από τον ατομικό πυρήνα. Τα ηλεκτρόνια μπαίνουν στο υποκέλυφος έχοντας τη χαμηλότερη δυνατή ενέργεια. Ένα τροχιακό μπορεί να κρατήσει το πολύ 2 ηλεκτρόνια που υπακούουν στην αρχή αποκλεισμού Pauli
Πώς χρησιμοποιείτε συμβατούς αριθμούς για την εκτίμηση της διαίρεσης;
Περίληψη Οι συμβατοί αριθμοί είναι αριθμοί που είναι κοντά στους αριθμούς που αντικαθιστούν και χωρίζονται ομοιόμορφα μεταξύ τους. Το πηλίκο είναι το αποτέλεσμα που παίρνετε όταν διαιρείτε. 56.000 είναι πολύ κοντά στις 55.304. Το 800 είναι πολύ κοντά στο 875, ΚΑΙ διαιρείται ομοιόμορφα σε 56.000
Πώς χρησιμοποιείτε την ιδιότητα μηδενικού προϊόντος;

Η ιδιότητα μηδενικού προϊόντος δηλώνει ότι εάν ab = 0, τότε είτε a = 0 είτε b = 0, είτε και τα δύο a και b είναι 0. Όταν το γινόμενο των παραγόντων είναι ίσο με μηδέν, ένας ή περισσότεροι από τους παράγοντες πρέπει επίσης να είναι μηδέν. Μόλις συντελεστεί το πολυώνυμο, ορίστε κάθε παράγοντα ίσο με μηδέν και λύστε τους ξεχωριστά
Πότε πρέπει να χρησιμοποιείτε τη συσχέτιση και πότε να χρησιμοποιείτε απλή γραμμική παλινδρόμηση;
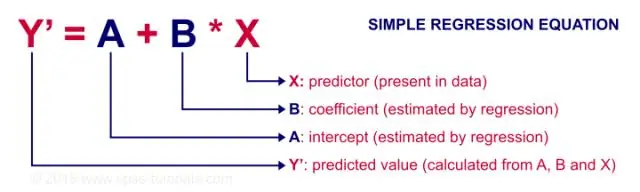
Η παλινδρόμηση χρησιμοποιείται κυρίως για τη δημιουργία μοντέλων/εξισώσεων για την πρόβλεψη μιας βασικής απόκρισης, Y, από ένα σύνολο μεταβλητών πρόβλεψης (X). Η συσχέτιση χρησιμοποιείται κυρίως για να συνοψίσει γρήγορα και συνοπτικά την κατεύθυνση και την ισχύ των σχέσεων μεταξύ ενός συνόλου 2 ή περισσότερων αριθμητικών μεταβλητών
