
- Συγγραφέας Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Τελευταία τροποποίηση 2025-01-22 16:57.
Πίνακας Θερμών Σχηματισμού
| Χημική ένωση | ΔHφά (kJ/mol) |
|---|---|
| CaCO3 | -1207.0 |
| CaO (μικρό) | -635.5 |
| Ca(OH)2(μικρό) | -986.6 |
| CaSO4(μικρό) | -1432.7 |
Ομοίως, τίθεται το ερώτημα, ποια είναι η ενθαλπία σχηματισμού MgO;
Η τυπική ενθαλπία σχηματισμού για MgO(s) είναι -601,7 kJ/mol.
Δεύτερον, ποια είναι η ενθαλπία σχηματισμού νερού; Η εξίσωση δείχνει ότι 286 kJ θερμικής ενέργειας δίνονται όταν 1 mole υγρού νερό σχηματίζεται από τα στοιχεία του υπό τυπικές συνθήκες. Πρότυπο ενθαλπία αλλαγές των σχηματισμός μπορεί να γραφτεί για οποιαδήποτε ένωση, ακόμα κι αν δεν μπορείτε να την φτιάξετε απευθείας από τα στοιχεία.
Επιπλέον, ποια είναι η ενθαλπία σχηματισμού του nh4cl;
Επιλεγμένη ενθαλπία σχηματισμού ATcT με βάση την έκδοση 1.118 του Thermochemical Network
| Όνομα είδους | Τύπος | ΔφάH°(298,15 K) |
|---|---|---|
| Χλωριούχο αμμώνιο | (NH4)Cl (cr) | -314.892 |
Ποια είναι η τυπική ενθαλπία σχηματισμού μιας ένωσης;
ο τυπική ενθαλπία σχηματισμού ή τυπική θερμότητα σχηματισμού του α χημική ένωση είναι η αλλαγή του ενθαλπία κατά τη διάρκεια της σχηματισμός από 1 mole της ουσίας από τα συστατικά στοιχεία της, με όλες τις ουσίες μέσα τους πρότυπο πολιτείες.
Συνιστάται:
Ποια είναι τα στάδια του σχηματισμού των άστρων;
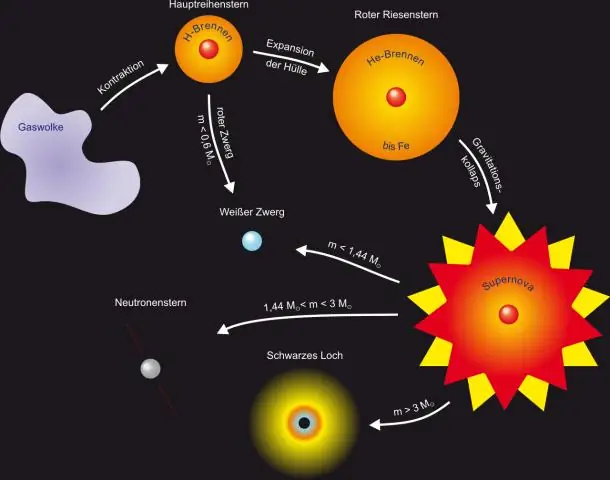
7 κύρια στάδια ενός αστεριού Ένα γιγάντιο σύννεφο αερίου. Ένα αστέρι ξεκινά τη ζωή ως ένα μεγάλο σύννεφο αερίου. A Protostar Is a Baby Star. Η Φάση T-Tauri. Αστέρια κύριας ακολουθίας. Επέκταση σε Red Giant. Σύντηξη Βαρύτερων Στοιχείων. Υπερκαινοφανείς και Πλανητικά Νεφελώματα
Ποια είναι η ενθαλπία του χλωριούχου ασβεστίου;

Η μετρούμενη τιμή για την ενθαλπία του διαλύματος για άνυδρο χλωριούχο ασβέστιο (η τιμή που προσπαθούμε να υπολογίσουμε εδώ) είναι περίπου -80 kJ mol-1
Ποια είναι η τυπική ενθαλπία σχηματισμού για το διοξείδιο του θείου;

Για έλεγχο, θα πρέπει να είναι (&μείον;296,81±0,20) kJ/mol. Θα πρέπει να χρησιμοποιείτε το NIST πιο συχνά. Πήρα στην πραγματικότητα &μείον;310,17 kJ/mol όμως. Πρέπει να αναζητήσετε πρώτα το ΔH∘f για SO3(g)
Γιατί η ενθαλπία σχηματισμού στοιχείων είναι μηδέν;

Η ενθαλπία σχηματισμού για ένα στοιχείο στη στοιχειακή του κατάσταση θα είναι πάντα 0, επειδή δεν χρειάζεται ενέργεια για να σχηματιστεί μια φυσική ένωση. Όταν μια ουσία σχηματίζεται από την πιο σταθερή μορφή των στοιχείων της, λαμβάνει χώρα μια αλλαγή στην ενθαλπία
Πώς βρίσκετε την τυπική ενθαλπία σχηματισμού από την καύση;

Η τυπική ενθαλπία της αντίδρασης (ΔHorxn) μπορεί να υπολογιστεί από το άθροισμα των τυπικών ενθαλπιών σχηματισμού των προϊόντων (καθεμία πολλαπλασιασμένη με τον στοιχειομετρικό της συντελεστή) μείον το άθροισμα των τυπικών ενθαλπιών σχηματισμού των αντιδρώντων (κάθε μία πολλαπλασιασμένη με την στοιχειομετρικός συντελεστής)-τα «προϊόντα
