
- Συγγραφέας Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Τελευταία τροποποίηση 2025-01-22 16:57.
Ideal Gas Νόμος. Ενα ιδανικό αέριο ορίζεται ως εκείνη στην οποία όλες οι συγκρούσεις μεταξύ ατόμων ή μορίων είναι απόλυτα ελαστικές και στην οποία δεν υπάρχουν διαμοριακές ελκτικές δυνάμεις. Κάποιος μπορεί να το οραματιστεί ως μια συλλογή από τέλεια σκληρές σφαίρες που συγκρούονται αλλά που διαφορετικά δεν αλληλεπιδρούν μεταξύ τους.
Αντίστοιχα, τι θεωρείται ιδανικό αέριο;
Ιδανικά αέρια ορίζονται ότι έχουν μόρια αμελητέου μεγέθους με μέση γραμμομοριακή κινητική ενέργεια που εξαρτάται μόνο από τη θερμοκρασία. Σε χαμηλή θερμοκρασία, τα περισσότερα αέρια συμπεριφέρονται αρκετά όπως ιδανικά αέρια ότι η ιδανικό αέριο ο νόμος μπορεί να εφαρμοστεί σε αυτούς. Ενα ιδανικό αέριο είναι επίσης γνωστό ως τέλειο αέριο.
Μπορεί επίσης να ρωτήσει κανείς, είναι ο αέρας ιδανικό αέριο; ιδανικός σημαίνει ότι δεν έχει ύπαρξη υπάρχει μόνο στο μυαλό των επιστημόνων. Όπως γνωρίζετε αέρας είναι μείγμα διαφορετικών αερίων που περιέχει κυρίως άζωτο και οξυγόνο τα οποία μόρια δείχνουν έλξη για το καθένα, οπότε μπορούμε να συμπεράνουμε ότι αέρας δεν είναι ιδανικό αέριο . αλλά μπορείτε να το φτιάξετε σε χαμηλή πίεση και υψηλή θερμοκρασία.
Σχετικά με αυτό, τι εξηγεί ο νόμος του ιδανικού αερίου;
Έτσι, συνοπτικά, το Νόμος για το Ιδανικό Αέριο δηλώνει ότι κάτω από την ίδια θερμοκρασία, πίεση και όγκο όλα αέρια περιέχουν τον ίδιο αριθμό μορίων (αλλά όχι την ίδια μάζα). Υπενθύμιση: Το Νόμος για το Ideal Gas δεν ισχύει όταν η θερμοκρασία και η πίεση είναι κοντά στο σημείο μετατροπής σε υγρό ή στερεό.
Υπάρχει ιδανικό αέριο;
Εκεί δεν είναι τέτοιο πράγμα όπως ένα ιδανικό αέριο φυσικά, αλλά πολλά αέρια συμπεριφέρονται περίπου σαν να ήταν ιδανικός σε συνηθισμένες θερμοκρασίες και πιέσεις εργασίας. Η πίεση οφείλεται σε συγκρούσεις μεταξύ των μορίων και των τοιχωμάτων του δοχείου.
Συνιστάται:
Πώς λύνετε τον νόμο του ιδανικού αερίου;

Τύπος του νόμου του ιδανικού αερίου Ερωτήσεις για τον τύπο του νόμου του ιδανικού αερίου: Απάντηση: Ο όγκος είναι V = 890,0 mL και η θερμοκρασία είναι T = 21°C και η πίεση είναι P = 750 mmHg. PV = nRT. Απάντηση: Ο αριθμός των moles είναι n = 3,00moles, η θερμοκρασία είναι T = 24°C και η πίεση είναι P = 762,4 mmHg. PV = nRT
Ποια είναι η εξίσωση του ιδανικού αερίου;

Η πιο κοινή μορφή αυτής της εξίσωσης είναι αφού PV= K και V/T =k τότε. PV/T = σταθερό. Έτσι, η Εξίσωση Ιδανικού Αερίου δίνεται ως. PV = nRT. όπου P= πίεση του αερίου. V=όγκος του αερίου. n= Αριθμός τυφλοπόντικων; T=Απόλυτη θερμοκρασία; R=Ιδανική σταθερά αερίου γνωστή και ως σταθερά Boltzmann = 0,082057 L atm K-1 mol-1
Ποιος είναι ο νόμος του ιδανικού αερίου στη χημεία;

Ένα ιδανικό αέριο είναι ένα υποθετικό αέριο που ονειρεύονται οι χημικοί και οι μαθητές γιατί θα ήταν πολύ πιο εύκολο αν δεν υπήρχαν πράγματα όπως οι διαμοριακές δυνάμεις να περιπλέκουν τον απλό νόμο του Ιδανικού Αερίου. Τα ιδανικά αέρια είναι ουσιαστικά σημειακές μάζες που κινούνται σε σταθερή, τυχαία, ευθύγραμμη κίνηση
Ποια είναι η διαφορά μεταξύ του ορισμού του Arrhenius και του ορισμού του brønsted Lowry για τα οξέα και τις βάσεις;

Η διαφορά μεταξύ των τριών θεωριών είναι ότι η θεωρία Arrhenius δηλώνει ότι τα οξέα περιέχουν πάντα Η+ και ότι οι βάσεις περιέχουν πάντα ΟΗ-. Ενώ το μοντέλο Bronsted-Lowry ισχυρίζεται ότι τα οξέα είναι δότες πρωτονίων και δέκτες pron, επομένως οι βάσεις δεν χρειάζεται να περιέχουν OH- έτσι τα οξέα δίνουν ένα πρωτόνιο στο νερό που σχηματίζει H3O+
Όταν ο όγκος ενός δείγματος αερίου μειώνεται η πίεση του δείγματος αερίου;
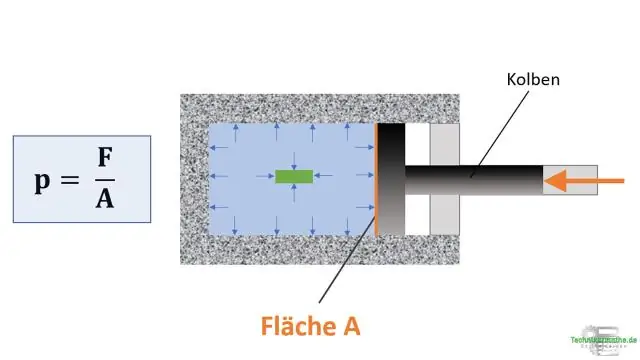
Μειούμενη πίεση Ο νόμος του συνδυασμένου αερίου δηλώνει ότι η πίεση ενός αερίου σχετίζεται αντιστρόφως με τον όγκο και σχετίζεται άμεσα με τη θερμοκρασία. Εάν η θερμοκρασία παραμείνει σταθερή, η εξίσωση ανάγεται στο νόμο του Boyle. Επομένως, εάν μειώσετε την πίεση μιας σταθερής ποσότητας αερίου, ο όγκος του θα αυξηθεί
