
- Συγγραφέας Miles Stephen stephen@answers-science.com.
- Public 2024-01-18 08:14.
- Τελευταία τροποποίηση 2025-01-22 16:57.
- Σχεδιάζω ο πυρήνας.
- Γράψτε τον αριθμό των νετρονίων και τον αριθμό των πρωτονίων στον πυρήνα.
- Σχεδιάζω το πρώτο επίπεδο ενέργειας.
- Σχεδιάζω τα ηλεκτρόνια στα ενεργειακά επίπεδα σύμφωνα με τους παρακάτω κανόνες.
- Παρακολουθήστε πόσα ηλεκτρόνια τοποθετούνται σε κάθε επίπεδο και τον αριθμό των ηλεκτρονίων που απομένουν για χρήση.
Έχοντας αυτό υπόψη, πώς λειτουργούν τα διαγράμματα Bohr;
Διαγράμματα Bohr δείχνουν ηλεκτρόνια που περιστρέφονται γύρω από τον πυρήνα ενός ατόμου κάπως σαν πλανήτες που περιφέρονται γύρω από τον ήλιο. Στο Μοντέλο Bohr , τα ηλεκτρόνια απεικονίζονται να ταξιδεύουν σε κύκλους σε διαφορετικά κελύφη, ανάλογα με το στοιχείο που έχετε. Κάθε κέλυφος μπορεί να χωρέσει μόνο συγκεκριμένο αριθμό ηλεκτρονίων.
Ομοίως, πόσα ηλεκτρόνια υπάρχουν σε ένα κέλυφος; Κάθε φλοιός μπορεί να περιέχει μόνο έναν σταθερό αριθμό ηλεκτρονίων: Το πρώτο κέλυφος μπορεί να αντέξει μέχρι δύο ηλεκτρόνια , το δεύτερο κέλυφος μπορεί να χωρέσει έως και οκτώ (2 + 6) ηλεκτρόνια, το τρίτο κέλυφος μπορεί να χωρέσει έως και 18 (2 + 6 + 10) και ούτω καθεξής. Ο γενικός τύπος είναι ότι το nο κέλυφος μπορεί κατ' αρχήν να χωρέσει έως και 2(n2) ηλεκτρόνια.
Αντίστοιχα, τι είναι το διάγραμμα Bohr;
Ένα διάγραμμα Bohr είναι μια απλοποιημένη οπτική αναπαράσταση ενός ατόμου που αναπτύχθηκε από τον Δανό φυσικό Niels Bohr το 1913. Το διάγραμμα απεικονίζει το άτομο ως θετικά φορτισμένο πυρήνας που περιβάλλεται από ηλεκτρόνια που ταξιδεύουν σε κυκλικές τροχιές γύρω από το πυρήνας σε διακριτά επίπεδα ενέργειας.
Πώς διαβάζετε ένα μοντέλο Bohr;
- Σχεδιάστε τον πυρήνα.
- Γράψτε τον αριθμό των νετρονίων και τον αριθμό των πρωτονίων στον πυρήνα.
- Σχεδιάστε το πρώτο επίπεδο ενέργειας.
- Σχεδιάστε τα ηλεκτρόνια στα ενεργειακά επίπεδα σύμφωνα με τους παρακάτω κανόνες.
- Παρακολουθήστε πόσα ηλεκτρόνια τοποθετούνται σε κάθε επίπεδο και τον αριθμό των ηλεκτρονίων που απομένουν για χρήση.
Συνιστάται:
Πώς σχεδιάζετε ένα διάγραμμα ελεύθερου σώματος;

Για να σχεδιάσουμε ένα διάγραμμα ελεύθερου σώματος, σχεδιάζουμε το αντικείμενο ενδιαφέροντος, σχεδιάζουμε όλες τις δυνάμεις που δρουν σε αυτό το αντικείμενο και επιλύουμε όλα τα διανύσματα δύναμης σε x– και y-συνιστώσες. Πρέπει να σχεδιάσουμε ένα ξεχωριστό διάγραμμα ελεύθερου σώματος για κάθε αντικείμενο στο πρόβλημα
Πώς σχεδιάζετε ένα φυτικό κύτταρο;

ΒΙΝΤΕΟ Τότε, πώς σχεδιάζετε ένα φυτό βήμα προς βήμα; Βήματα Συγκεντρώστε ό,τι χρειάζεστε. Κάντε τη βασική δομή να ξεκινά με ένα ορθογώνιο με μια γραμμή να προεξέχει από αυτό. Κάντε ένα τραπέζι κάτω από το ορθογώνιο (που αργότερα θα γίνει η κατσαρόλα).
Πώς σχεδιάζετε ένα γράφημα ταχύτητας έναντι χρόνου;
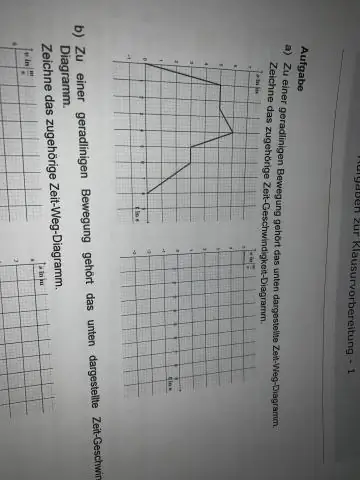
Σχεδιάστε σε γραφικό χαρτί δύο ευθείες γραμμές που ξεκινούν από το ίδιο σημείο και είναι κάθετες μεταξύ τους. Αυτός είναι ο άξονας x-y. Ο άξονας x είναι η οριζόντια γραμμή και ο άξονας y είναι η κατακόρυφη γραμμή. Σημειώστε κατάλληλα χρονικά διαστήματα με ίσα διαστήματα στον άξονα x, έτσι ώστε να μπορείτε εύκολα να απεικονίσετε τις χρονικές τιμές από τον πίνακα
Πώς σχεδιάζετε ένα γράφημα απόστασης έναντι χρόνου;
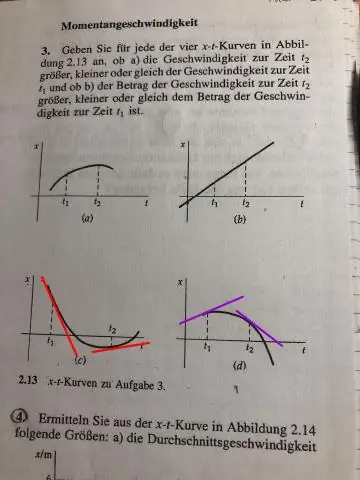
Το γράφημα χρόνου απόστασης είναι ένα γραμμικό γράφημα που υποδηλώνει τα ευρήματα απόστασης έναντι χρόνου στο γράφημα. Η σχεδίαση γραφήματος απόστασης-χρόνου είναι απλή. Για αυτό, παίρνουμε πρώτα ένα φύλλο γραφικού χαρτιού και σχεδιάζουμε δύο κάθετες ευθείες πάνω του που ενώνονται στο Ο. Η οριζόντια ευθεία είναι ο άξονας Χ, ενώ η ευθεία κατακόρυφης είναι ο άξονας Υ
Πώς σας λέει ένα διάγραμμα ελεύθερου σώματος για την καθαρή δύναμη σε ένα αντικείμενο;

Ένα διάγραμμα ελεύθερου σώματος δείχνει τα διανύσματα για όλες τις δυνάμεις που ασκούνται στο σώμα. Το προκύπτον διάνυσμα που βρέθηκε αθροίζοντας όλα τα μεμονωμένα διανύσματα αντιπροσωπεύει την καθαρή δύναμη. Εφόσον F = ma, το διάνυσμα επιτάχυνσης θα δείχνει προς την ίδια κατεύθυνση με την καθαρή δύναμη, με μέγεθος F / m
