
- Συγγραφέας Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Τελευταία τροποποίηση 2025-01-22 16:57.
Τα μόρια του νερού, για παράδειγμα, συγκρατούνται μεταξύ τους υδρογόνο δεσμούς μεταξύ των υδρογόνο άτομο ενός μορίου και το άτομο οξυγόνου ενός άλλου (εικ: υδρογόνο δεσμούς). Υδρογόνο Οι δεσμοί είναι μια σχετικά ισχυρή διαμοριακή δύναμη και είναι ισχυρότεροι από άλλες δυνάμεις διπόλου-διπόλου.
Ομοίως, μπορείτε να ρωτήσετε, τι είδους δεσμούς σχηματίζονται μεταξύ των μορίων του νερού;
Υδρογόνο δεσμούς είναι δεσμούς μεταξύ ένα υδρογόνο σε έναν πολικό μόριο και το αρνητικά φορτισμένο άκρο ενός άλλου πολικού μόριο . Υδρογόνο δεσμούς επιτρέψτε δύο μόρια να συνδεθούν προσωρινά. Μόρια νερού αποτελούνται από δύο άτομα υδρογόνου και ένα άτομο οξυγόνου, που συγκρατούνται μεταξύ τους από πολικό ομοιοπολικό δεσμούς.
Μπορεί επίσης να ρωτήσει κανείς, γιατί υπάρχουν διαμοριακές δυνάμεις μεταξύ των μορίων του νερού; Νερό έχει πολικούς δεσμούς Ο-Η. Τα αρνητικά άτομα Ο προσελκύουν τα θετικά άτομα Η σε κοντινή απόσταση μόρια , που οδηγεί στον ασυνήθιστα ισχυρό τύπο διπόλου-διπόλου δύναμη που ονομάζεται δεσμός υδρογόνου. Οι δεσμοί υδρογόνου είναι ο πιο δυνατός δύναμη , αλλά τα άλλα είδη διαμοριακή αξιοθεατο είναι ακόμα παρόντες.
Γνωρίζετε επίσης, τι είναι ένας διαμοριακός δεσμός στο νερό;
Υδρογόνο Δεσμούς Ο πιο δυνατός διαμοριακή δύναμη μέσα νερό είναι ένα ιδιαίτερο δίπολο δεσμός που ονομάζεται υδρογόνο δεσμός . Σε νερό , ένα μόριο μπορεί να σχηματίσει έως και τέσσερα υδρογόνο δεσμούς , με ένα μόριο για κάθε άτομο υδρογόνου και με δύο άτομα υδρογόνου στην αρνητική πλευρά του οξυγόνου.
Τι είδους δεσμός είναι το νερό;
Νερό είναι ένα πολικό μόριο Α νερό μόριο σχηματίζεται όταν δύο άτομα υδρογόνου δεσμός ομοιοπολικά με ένα άτομο οξυγόνου. Σε ομοιοπολικό δεσμός Τα ηλεκτρόνια μοιράζονται μεταξύ των ατόμων. Σε νερό η κατανομή δεν είναι ίση. Το άτομο οξυγόνου έλκει τα ηλεκτρόνια πιο έντονα από το υδρογόνο.
Συνιστάται:
Ποιες διαμοριακές δυνάμεις θα επηρέαζαν τις αλληλεπιδράσεις των μορίων του νερού;

1 Απάντηση. Στην πραγματικότητα, το νερό έχει και τους τρεις τύπους διαμοριακών δυνάμεων, με την ισχυρότερη να είναι ο δεσμός υδρογόνου. Όλα τα πράγματα έχουν τη διασπορά του Λονδίνου που οι πιο αδύναμες αλληλεπιδράσεις είναι τα προσωρινά δίπολα που σχηματίζονται με μετατόπιση ηλεκτρονίων μέσα σε ένα μόριο
Πώς μπορεί ο δεσμός υδρογόνου μεταξύ των μορίων του νερού να εξηγήσει την ικανότητα του νερού να απορροφά μεγάλες ποσότητες ενέργειας πριν από την εξάτμιση;
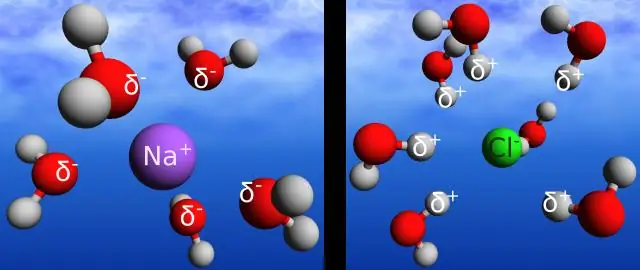
Οι δεσμοί υδρογόνου στο νερό του επιτρέπουν να απορροφά και να απελευθερώνει θερμική ενέργεια πιο αργά από πολλές άλλες ουσίες. Η θερμοκρασία είναι ένα μέτρο της κίνησης (κινητικής ενέργειας) των μορίων. Καθώς η κίνηση αυξάνεται, η ενέργεια είναι υψηλότερη και επομένως η θερμοκρασία είναι υψηλότερη
Υπάρχουν διαφορές μεταξύ των αρσενικών κώνων κωνοφόρων και των θηλυκών κώνων κωνοφόρων;

Τα κουκουνάρια που συνήθως θεωρούνται κουκουνάρια είναι στην πραγματικότητα τα μεγαλύτερα θηλυκά κουκουνάρια. Τα αρσενικά κουκουνάρια δεν είναι τόσο ξυλώδη και είναι πολύ μικρότερα σε μέγεθος. Τα θηλυκά κουκουνάρια συγκρατούν τους σπόρους ενώ τα αρσενικά κουκουνάρια περιέχουν τη γύρη. Τα περισσότερα κωνοφόρα, ή κωνοφόρα δέντρα, έχουν θηλυκά και αρσενικά κουκουνάρια στο ίδιο δέντρο
Ποια είναι η διαφορά μεταξύ του ορισμού του Arrhenius και του ορισμού του brønsted Lowry για τα οξέα και τις βάσεις;

Η διαφορά μεταξύ των τριών θεωριών είναι ότι η θεωρία Arrhenius δηλώνει ότι τα οξέα περιέχουν πάντα Η+ και ότι οι βάσεις περιέχουν πάντα ΟΗ-. Ενώ το μοντέλο Bronsted-Lowry ισχυρίζεται ότι τα οξέα είναι δότες πρωτονίων και δέκτες pron, επομένως οι βάσεις δεν χρειάζεται να περιέχουν OH- έτσι τα οξέα δίνουν ένα πρωτόνιο στο νερό που σχηματίζει H3O+
Ποιες είναι οι ομοιότητες μεταξύ των μετάλλων, των μη μετάλλων και των μεταλλοειδών;

Αντίθετα, τα μεταλλοειδή είναι πιο εύθραυστα σε σύγκριση με τα μέταλλα που είναι όλκιμα και ελατά (αν είναι στερεά). Σε σύγκριση με τα αμέταλλα, τα μεταλλοειδή μπορεί να είναι μονωτικά και εύθραυστα (εάν τα αμέταλλα είναι σε στερεά μορφή). Αντίθετα, τα αμέταλλα δεν είναι τόσο γυαλιστερά όσο τα μεταλλοειδή και τα περισσότερα από τα αμέταλλα είναι αέρια
