
- Συγγραφέας Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Τελευταία τροποποίηση 2025-01-22 16:57.
ΒΙΝΤΕΟ
Τότε, πώς λύνετε προβλήματα ατομικής μάζας;
Προς το υπολογίζω ο ατομική μάζα ενός μόνο ατόμου ενός στοιχείου, αθροίστε το μάζα των πρωτονίων και των νετρονίων. Παράδειγμα: Βρείτε το ατομική μάζα ενός ισοτόπου άνθρακα που έχει 7 νετρόνια. Μπορείτε να δείτε από τον περιοδικό πίνακα ότι ο άνθρακας έχει ένα ατομικός αριθμός 6, που είναι ο αριθμός των πρωτονίων του.
Επιπλέον, τι είναι ο ατομικός μαζικός αριθμός; ο μαζικός αριθμός (σύμβολο Α, από τη γερμανική λέξη Atomgewicht [ ατομικός βάρος]), που ονομάζεται επίσης ατομικός μαζικός αριθμός ή νουκλεόν αριθμός , είναι το σύνολο αριθμός των πρωτονίων και των νετρονίων (μαζί γνωστά ως νουκλεόνια) σε ένα ατομικός πυρήνας. ο μαζικός αριθμός είναι διαφορετικό για κάθε διαφορετικό ισότοπο ενός χημικού στοιχείου.
Επίσης να γνωρίζουμε είναι, ποιος είναι ο τύπος της ατομικής μάζας;
Μέση τιμή ατομική μάζα = στ1Μ1 + στ2Μ2 +… + στ Μ όπου f είναι το κλάσμα που αντιπροσωπεύει τη φυσική αφθονία του ισοτόπου και M είναι το μάζα αριθμός (βάρος) του ισοτόπου. Ο μέσος όρος ατομική μάζα ενός στοιχείου μπορεί να βρεθεί στον περιοδικό πίνακα, συνήθως κάτω από το στοιχειακό σύμβολο.
Ποια είναι η μέση ατομική μάζα στη χημεία;
ο μέση ατομική μάζα ενός στοιχείου είναι το άθροισμα των μάζες των ισοτόπων του, το καθένα πολλαπλασιασμένο με τη φυσική του αφθονία (το δεκαδικό που σχετίζεται με το ποσοστό του άτομα του στοιχείου που είναι ενός δεδομένου ισοτόπου).
Συνιστάται:
Ποια είναι η διαφορά μεταξύ της μάζας ενός πρωτονίου και της μάζας ενός ηλεκτρονίου;
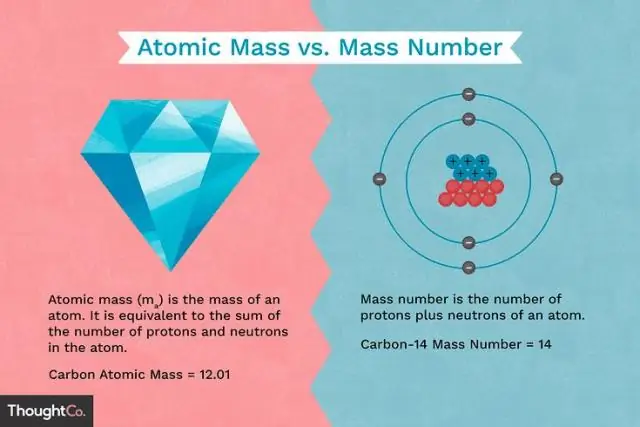
Τα πρωτόνια και τα νετρόνια έχουν περίπου την ίδια μάζα, αλλά και τα δύο έχουν πολύ μεγαλύτερη μάζα από τα ηλεκτρόνια (περίπου 2.000 φορές μεγαλύτερη μάζα από ένα ηλεκτρόνιο). Το θετικό φορτίο σε ένα πρωτόνιο είναι ίσο σε μέγεθος με το αρνητικό φορτίο ενός ηλεκτρονίου
Πώς επιλύετε προβλήματα περιοριστικής μάζας αντιδραστηρίων;

Βρείτε το περιοριστικό αντιδραστήριο υπολογίζοντας και συγκρίνοντας την ποσότητα του προϊόντος που θα παράγει κάθε αντιδραστήριο. Ισορροπήστε τη χημική εξίσωση για τη χημική αντίδραση. Μετατρέψτε τις δεδομένες πληροφορίες σε κρεατοελιές. Χρησιμοποιήστε στοιχειομετρία για κάθε μεμονωμένο αντιδρών για να βρείτε τη μάζα του παραγόμενου προϊόντος
Πώς υπολογίζετε τα προβλήματα ογκομέτρησης;

Πρόβλημα τιτλοδότησης Βήμα προς βήμα Λύση Βήμα 1: Προσδιορίστε το [OH-] Κάθε mole NaOH θα έχει ένα mole OH-. Βήμα 2: Προσδιορίστε τον αριθμό των γραμμομορίων ΟΗ- Μοριακότητα = αριθμός γραμμομορίων/όγκος. Βήμα 3: Προσδιορίστε τον αριθμό των mol H+ Βήμα 4: Προσδιορίστε τη συγκέντρωση του HCl
Γιατί ένα αστέρι μεγάλης μάζας εξελίσσεται διαφορετικά από ένα αστέρι χαμηλής μάζας;

Γιατί ένα αστέρι μεγάλης μάζας εξελίσσεται διαφορετικά από ένα αστέρι χαμηλής μάζας; Α) Μπορεί να κάψει περισσότερα καύσιμα επειδή ο πυρήνας του μπορεί να ζεσταθεί περισσότερο. Έχει χαμηλότερη βαρύτητα, επομένως δεν μπορεί να τραβήξει περισσότερο καύσιμο από το διάστημα
Πώς μετριέται η μονάδα ατομικής μάζας;

Μονάδα ατομικής μάζας. Μια μονάδα ατομικής μάζας (συντομογραφία: amu, u ή Da) είναι μια μονάδα μέτρησης που χρησιμοποιείται για τη μέτρηση της μάζας των ατόμων. Η μονάδα ατομικής μάζας είναι ίση με το ~1⁄12 της μάζας του άνθρακα-12. Η λέξη «ντάλτον» χρησιμοποιείται περισσότερο με την πάροδο του χρόνου
