
Πίνακας περιεχομένων:
- Συγγραφέας Miles Stephen [email protected].
- Public 2023-12-15 23:35.
- Τελευταία τροποποίηση 2025-01-22 16:57.
12.38 Ποιο από κάθε ζευγάρι έχει ο πιο ψηλά πίεση ατμών (α) C2H6 ή C4H10 : Το C2H6 έχει ο πιο ψηλά πίεση ατμού. Υπάρχουν μόνο δυνάμεις διασποράς, και αυτές είναι ισχυρότερες στο βαρύτερο C4H10 μόριο. Σε περιπτώσεις όπως αυτή, τα βαρύτερα μόρια, τα οποία έχει ισχυρότερες δυνάμεις διασποράς, θέληση έχω ο υψηλότερο σημείο βρασμού.
Κατά συνέπεια, το c3h8 ή το c4h10 έχουν υψηλότερο σημείο βρασμού;
C2H6 < C3H8 < C4H10 . Όλες αυτές οι ενώσεις είναι μη πολικές και μόνο έχω Δυνάμεις διασποράς του Λονδίνου: όσο μεγαλύτερο είναι το μόριο, τόσο μεγαλύτερες είναι οι δυνάμεις διασποράς και η πιο ψηλά ο σημείο βρασμού.
Ομοίως, ποιο θα είχε υψηλότερο σημείο βρασμού; Η σχετική ισχύς των τεσσάρων διαμοριακών δυνάμεων είναι: Ιονική > Δεσμός υδρογόνου > δίπολο δίπολο > δυνάμεις διασποράς Van der Waals. Η επιρροή καθεμιάς από αυτές τις ελκυστικές δυνάμεις θα εξαρτώνται από τις λειτουργικές ομάδες που υπάρχουν. Σημεία βρασμού αυξάνεται καθώς αυξάνεται ο αριθμός των ανθράκων.
Γνωρίζετε επίσης, ποια ένωση θα περιμένατε να έχει το υψηλότερο σημείο βρασμού;
Όσο ισχυρότερη είναι η διαμοριακή δύναμη, τόσο πιο ψηλά ο σημείο βρασμού . Γενικά, ο δεσμός υδρογόνου είναι ισχυρότερος από τις έλξεις διπόλου-διπόλου, που είναι ισχυρότερες από τις δυνάμεις διασποράς του Λονδίνου.
Πώς προσδιορίζετε το σημείο βρασμού;
Παράδειγμα ανύψωσης σημείου βρασμού
- Η γλυκόζη είναι η διαλυμένη μας ουσία και το νερό είναι ο διαλύτης.
- Kb για νερό είναι 0,51 βαθμοί Κελσίου kg/mol.
- Η μοριακή μάζα της γλυκόζης είναι 180 g/mol.
- Το σημείο βρασμού του νερού είναι 100 βαθμοί Κελσίου.
- Η εξίσωση για την ανύψωση του σημείου βρασμού είναι δέλτα T = mKb.
Συνιστάται:
Ποιο έχει το υψηλότερο σημείο βρασμού CCl4 cf4 ή CBr4;

Εξαρτάται από τον αριθμό των ηλεκτρονίων. Το CBr4 έχει 146, σε σύγκριση με 42 στο CF4 και 74 στο CCl4. Το CBr4 είναι το υψηλότερο σημείο βρασμού
Το αιθάνιο ή το αιθένιο έχουν υψηλότερο σημείο βρασμού;

Το αιθάνιο έχει ισχυρότερες διαμοριακές έλξεις (δυνάμεις van der Waal) από το αιθένιο και έτσι έχει το υψηλότερο σημείο βρασμού
Γιατί η αιθυλική αλκοόλη έχει υψηλότερο σημείο βρασμού από τη μεθυλική αλκοόλη;

Η αιθανόλη έχει υψηλότερο σημείο βρασμού από τη μεθανόλη. Ως εκ τούτου, απαιτείται περισσότερη ενέργεια για να υπερνικηθούν οι διαμοριακές δυνάμεις, με αποτέλεσμα την αύξηση των σημείων βρασμού/τήξης
Τι κάνει μια ένωση να έχει υψηλότερο σημείο βρασμού;

Τα μεγάλα μόρια έχουν περισσότερα ηλεκτρόνια και πυρήνες που δημιουργούν ελκτικές δυνάμεις van der Waals, επομένως οι ενώσεις τους έχουν συνήθως υψηλότερα σημεία βρασμού από παρόμοιες ενώσεις που αποτελούνται από μικρότερα μόρια. Είναι πολύ σημαντικό να εφαρμόζεται αυτός ο κανόνας μόνο σε παρόμοιες ενώσεις
Γιατί το νερό έχει υψηλό σημείο βρασμού και σημείο τήξης;
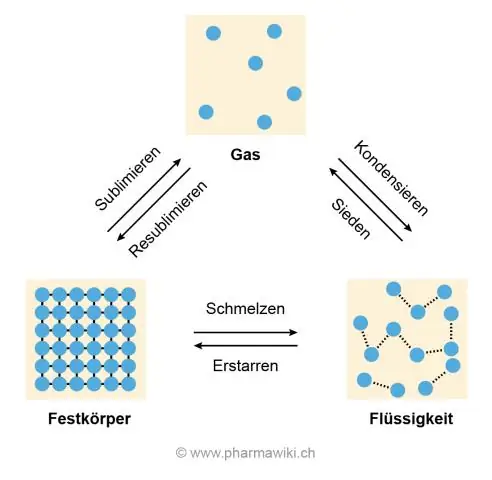
Ο λόγος για τις υψηλές θερμοκρασίες τήξης και βρασμού είναι ο δεσμός υδρογόνου μεταξύ των μορίων του νερού που τα αναγκάζει να κολλήσουν μεταξύ τους και να αντιστέκονται στην απομάκρυνση, κάτι που συμβαίνει όταν ο πάγος λιώνει και το νερό βράζει για να γίνει αέριο
