
- Συγγραφέας Miles Stephen stephen@answers-science.com.
- Public 2024-01-18 08:14.
- Τελευταία τροποποίηση 2025-01-22 16:57.
Στοιχεία περιλαμβάνονται σε αυτό ομάδα περιλαμβάνουν το βηρύλλιο, το μαγνήσιο, το ασβέστιο, το στρόντιο, το βάριο και το ράδιο.
Φυσικές ιδιότητες:
- Φυσικός φύση:
- Ατομικός όγκος και ακτίνα:
- Πυκνότητα:
- Σημεία τήξης και βρασμού:
- Ενέργεια Ιονισμού:
- Κατάσταση οξείδωσης:
- Ηλεκτροθετικότητα:
- Ηλεκτραρνητικότητα:
Εδώ, ποιες είναι οι ιδιότητες των στοιχείων της ομάδας 2;
Ιδιότητες Στοιχείων Ομάδας 2 Αυτό ομάδα περιλαμβάνει βηρύλλιο, μαγνήσιο, ασβέστιο, στρόντιο, βάριο και ράδιο. Όντας μέσα ομάδα 2 σημαίνει ότι όλα έχουν δύο ηλεκτρόνια σθένους, ή τα ηλεκτρόνια που βρίσκονται πιο μακριά από τον πυρήνα. Αυτά τα ηλεκτρόνια σθένους είναι συνήθως τα ηλεκτρόνια που εμπλέκονται στις αντιδράσεις.
Δεύτερον, ποιες είναι οι φυσικές ιδιότητες των μετάλλων των αλκαλικών γαιών; Ιδιότητες αλκαλικών γαιών μετάλλων
- λαμπερός.
- ασημί-λευκό.
- κάπως αντιδραστικά μέταλλα σε τυπική θερμοκρασία και πίεση.
- χάνουν εύκολα τα δύο εξώτατα ηλεκτρόνια τους για να σχηματίσουν κατιόντα με φορτίο 2+.
- χαμηλές πυκνότητες.
- χαμηλά σημεία τήξης.
- χαμηλά σημεία βρασμού.
Λαμβάνοντας υπόψη αυτό, ποιες είναι οι φυσικές και χημικές ιδιότητες των στοιχείων της Ομάδας 2;
Ομάδα 2 περιέχει απαλό, ασήμι μέταλλα που έχουν λιγότερο μεταλλικό χαρακτήρα από το Ομάδα 1 στοιχεία . Αν και πολλές Χαρακτηριστικά είναι κοινά σε όλη την ομάδα , τόσο πιο βαρύ μέταλλα όπως τα Ca, Sr, Ba και Ra είναι σχεδόν το ίδιο αντιδραστικά με το Ομάδα 1 Αλκάλι μέταλλα.
Ποιες είναι οι φυσικές ιδιότητες των στοιχείων της ομάδας 1;
ο στοιχεία της ομάδας 1 είναι όλα μαλακά, αντιδραστικά μέταλλα με χαμηλά σημεία τήξης. Αντιδρούν με το νερό και παράγουν διάλυμα υδροξειδίου αλκαλικού μετάλλου και υδρογόνο. Η αντιδραστικότητα αυξάνεται προς τα κάτω ομάδα.
Συνιστάται:
Πώς συγκρίνεται η αφθονία των στοιχείων στη Γη με την αφθονία των στοιχείων στον άνθρωπο;

Το οξυγόνο είναι το πιο άφθονο στοιχείο τόσο στη Γη όσο και στους ανθρώπους. Η αφθονία των στοιχείων που σχηματίζουν οργανικές ενώσεις αυξάνεται στους ανθρώπους ενώ η αφθονία των μεταλλοειδών αυξάνεται στη Γη. Τα στοιχεία που είναι άφθονα στη Γη είναι απαραίτητα για τη διατήρηση της ζωής
Ποιες είναι οι διαφορετικές φυσικές και χημικές ιδιότητες των ορυκτών;

Τα ορυκτά ταξινομούνται με βάση τη χημική τους σύσταση, η οποία εκφράζεται στις φυσικές τους ιδιότητες. Αυτή η ενότητα, η δεύτερη σε μια σειρά για ορυκτά, περιγράφει τις φυσικές ιδιότητες που χρησιμοποιούνται συνήθως για την αναγνώριση ορυκτών. Αυτά περιλαμβάνουν χρώμα, κρυσταλλική μορφή, σκληρότητα, πυκνότητα, λάμψη και διάσπαση
Πόσα ηλεκτρόνια υπάρχουν στο εξωτερικό περίβλημα των στοιχείων της Ομάδας 6;

Τα άτομα των στοιχείων της ομάδας 1 έχουν ένα ηλεκτρόνιο στο εξωτερικό τους περίβλημα και τα άτομα των στοιχείων της ομάδας 2 έχουν δύο ηλεκτρόνια στο εξωτερικό τους περίβλημα. Ορισμένα στοιχεία στις ομάδες 6 και 7 και όλα στην ομάδα 0 (γνωστά και ως ομάδα 8) είναι αμέταλλα
Ποιες από τις παρακάτω είναι όλες οι φυσικές ιδιότητες της ύλης;
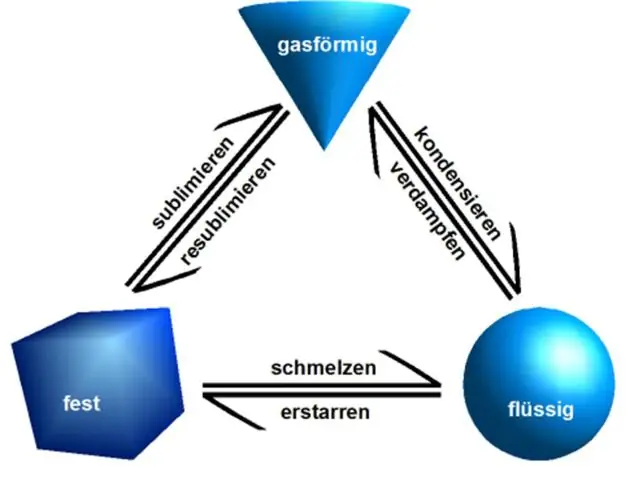
Φυσικές ιδιότητες: Οι φυσικές ιδιότητες μπορούν να παρατηρηθούν ή να μετρηθούν χωρίς αλλαγή της σύστασης της ύλης. Οι φυσικές ιδιότητες περιλαμβάνουν: εμφάνιση, υφή, χρώμα, οσμή, σημείο τήξης, σημείο βρασμού, πυκνότητα, διαλυτότητα, πολικότητα και πολλά άλλα
Ποιες είναι οι φυσικές ιδιότητες των ορυκτών;

Οι ακόλουθες φυσικές ιδιότητες των ορυκτών μπορούν εύκολα να χρησιμοποιηθούν για την αναγνώριση ενός ορυκτού: Χρώμα. Ράβδωση. Σκληρότητα. Διάσπαση ή Κάταγμα. Κρυσταλλική Δομή. Διαφάνεια ή Ποσότητα Διαφάνειας. Επιμονή. Μαγνητισμός
