
- Συγγραφέας Miles Stephen [email protected].
- Public 2023-12-15 23:35.
- Τελευταία τροποποίηση 2025-01-22 16:57.
Το χλώριο ισότοπο με 18 νετρόνια έχει αφθονία 0,7577 και μαζικό αριθμό 35 amu. Για να υπολογίσετε το μέση τιμή ατομική μάζα, πολλαπλασιάστε το κλάσμα με τον μαζικό αριθμό για το καθένα ισότοπο , στη συνέχεια προσθέστε τα μαζί.
Ομοίως, ποιος είναι ο σταθμισμένος μέσος όρος όλων των ισοτόπων ενός στοιχείου;
Χρησιμοποιώντας τις μάζες του διαφορετικού ισότοπα και πόσο άφθονο το καθένα ισότοπο είναι, μπορούμε να βρούμε το μέση τιμή μάζα των ατόμων ενός στοιχείο . Η ατομική μάζα ενός στοιχείο είναι το σταθμισμένος μέσος όρος μάζα των ατόμων σε ένα φυσικά απαντώμενο δείγμα του στοιχείο . Η ατομική μάζα αναφέρεται συνήθως σε μονάδες ατομικής μάζας.
τι έχει μάζα 1 amu; Μια μονάδα ατομικής μάζας (που συμβολίζεται AMU ή amu) ορίζεται ακριβώς ως το 1/12 της μάζας ενός ατόμου άνθρακα-12. Το άτομο άνθρακα-12 (C-12) έχει έξι πρωτόνια και έξι νετρόνια στον πυρήνα του. Σε ανακριβείς όρους, ένα AMU είναι ο μέσος όρος του πρωτόνιο μάζα ανάπαυσης και η νετρόνιο μάζα ανάπαυσης.
Δεύτερον, πώς υπολογίζετε την εκατοστιαία αφθονία χρησιμοποιώντας την ατομική μάζα;
Αλλάξτε το καθένα τοις εκατό αφθονία σε δεκαδική μορφή διαιρώντας με το 100. Πολλαπλασιάστε αυτή την τιμή με το ατομική μάζα αυτού του ισοτόπου. Προσθέστε μαζί για κάθε ισότοπο για να λάβετε τον μέσο όρο ατομική μάζα.
Ποια είναι η διαφορά μεταξύ ατομικής μάζας και ατομικού βάρους;
Ατομική μάζα (Μένα) είναι το μάζα ενός άτομο . Ενα μονό άτομο έχει έναν καθορισμένο αριθμό πρωτονίων και νετρονίων, οπότε το μάζα είναι μονοσήμαντο (δεν θα αλλάξει) και είναι το άθροισμα του αριθμού των πρωτονίων και των νετρονίων στο άτομο . Ατομικό βάρος είναι ένας σταθμισμένος μέσος όρος του μάζα όλων των άτομα ενός στοιχείου, με βάση την αφθονία των ισοτόπων.
Συνιστάται:
Πώς ερμηνεύετε το σταθμισμένο μέσο;

Περίληψη. Σταθμισμένος μέσος όρος: Ένας μέσος όρος όπου ορισμένες αξίες συνεισφέρουν περισσότερο από άλλες. Όταν τα βάρη προστεθούν στο 1: απλώς πολλαπλασιάστε κάθε βάρος με την αντίστοιχη τιμή και αθροίστε τα όλα. Διαφορετικά, πολλαπλασιάστε κάθε βάρος w με την αντίστοιχη τιμή του x, αθροίστε όλα πάνω και διαιρέστε με το άθροισμα των βαρών: Σταθμισμένος μέσος όρος = ΣwxΣw
Πώς δημιουργείτε έναν σταθμισμένο μέσο όρο σε έναν συγκεντρωτικό πίνακα;

Σταθμισμένοι μέσοι όροι σε έναν Συγκεντρωτικό Πίνακα Κάντε κλικ στο κάτω βέλος δίπλα στη λέξη Συγκεντρωτικός πίνακας στην αριστερή πλευρά της γραμμής εργαλείων του Συγκεντρωτικού πίνακα. Επιλέξτε Τύποι | Υπολογιζόμενα Πεδία. Στο πλαίσιο Όνομα, πληκτρολογήστε ένα όνομα για το νέο σας πεδίο. Στο πλαίσιο Τύπος, εισαγάγετε τον τύπο που θέλετε να χρησιμοποιηθεί για τον σταθμισμένο μέσο όρο σας, όπως =WeightedValue/Weight. Κάντε κλικ στο OK
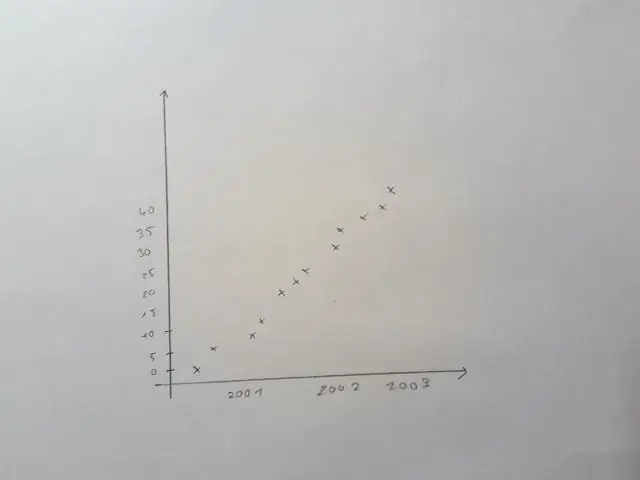
Πώς βρίσκετε τον επόμενο όρο σε μια τετραγωνική ακολουθία;
Γράψτε τον nο όρο αυτής της τετραγωνικής ακολουθίας αριθμών. Βήμα 1: Επιβεβαιώστε εάν η ακολουθία είναι τετραγωνική. Αυτό γίνεται με την εύρεση της δεύτερης διαφοράς. Βήμα 2: Αν διαιρέσετε τη δεύτερη διαφορά με το 2, θα πάρετε την τιμή του a
Πώς υπολογίζετε τον μέσο όρο σε PHP;
Όποτε θέλετε να πάρετε τον μέσο όρο, διαιρέστε το άθροισμα με το πλήθος (φροντίζοντας φυσικά για την περίπτωση του count == 0). Όποτε θέλετε να συμπεριλάβετε έναν νέο αριθμό, προσθέστε τον νέο αριθμό στο άθροισμα και αυξήστε το πλήθος κατά 1
Πώς βρίσκετε το μέσο όρο χρησιμοποιώντας το Excel;
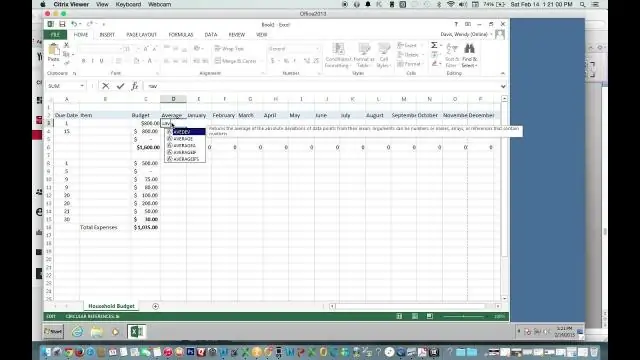
Χρησιμοποιήστε το AutoSum για να βρείτε γρήγορα τον μέσο όρο Κάντε κλικ σε ένα κελί κάτω από τη στήλη ή στα δεξιά της σειράς των αριθμών για τους οποίους θέλετε να βρείτε τον μέσο όρο. Στην καρτέλα HOME, κάντε κλικ στο βέλος δίπλα στην επιλογή AutoSum > Average και, στη συνέχεια, πατήστε Enter
