
- Συγγραφέας Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Τελευταία τροποποίηση 2025-06-01 05:04.
Ομοιοπολικός δεσμός είναι ο τύπος δεσμού που συγκρατεί τα άτομα μέσα σε ένα πολυατομικό ιόν. Χρειάζονται δύο ηλεκτρόνια για να γίνει το α ομοιοπολικό δεσμό , ένα από κάθε συνδετικό άτομο. Οι δομές κουκίδων Lewis είναι ένας τρόπος για να αναπαραστήσουμε πώς σχηματίζονται τα άτομα ομοιοπολικούς δεσμούς.
Ομοίως, πώς συνδυάζετε πολυατομικά ιόντα;
Ένας άλλος τρόπος σχηματισμού πολυατομικά ιόντα είναι από συνδυάζοντας τους με ένα ή περισσότερα υδρογόνο ιόντων , Χ+. Για παράδειγμα, θα μπορούσαμε συνδυασμός H+ με ανθρακικό, CO32- για να σχηματιστεί όξινο ανθρακικό, HCO3-. Παρατηρήστε ότι η συνολική χρέωση είναι 1- επειδή το 1+ στο H+ συνδυασμός με το 2- on CO32-.
Μπορεί επίσης να ρωτήσει κανείς, οι ενώσεις με πολυατομικά ιόντα είναι ιοντικές ή ομοιοπολικές; Πολυατομικά ιόντα είναι ιόντων . Ωστόσο, τα άτομα σε πολυατομικά ιόντα συγκρατούνται μαζί από ομοιοπολική δεσμούς. Ενώσεις που περιέχει πολυατομικά ιόντα είναι ιοντικές ενώσεις . Ο βασικός εμπειρικός κανόνας είναι ιοντικές ενώσεις λαμβάνουν χώρα μεταξύ ενός θετικού ιωνικός μέταλλο και ένα αρνητικό ιωνικός μη μέταλλο.
Εκτός από αυτό, ποιος συνδυασμός στοιχείων θα σχηματίσει έναν ιοντικό δεσμό;
Ενα ιοντικός δεσμός είναι ένα είδος χημικής ουσίας δεσμός που σχηματίζεται μέσω μιας ηλεκτροστατικής έλξης μεταξύ δύο αντίθετα φορτισμένων ιόντων . Ιωνικοί δεσμοί σχηματίζονται μεταξύ ενός κατιόντος, το οποίο είναι συνήθως μέταλλο, και ενός ανιόντος, το οποίο είναι συνήθως ένα μη μέταλλο. Ένα ομοιοπολικό δεσμός περιλαμβάνει ένα ζεύγος ηλεκτρονίων που μοιράζονται μεταξύ των ατόμων.
Ποια δύο στοιχεία είναι πιο πιθανό να συνδεθούν μεταξύ τους;
Οξυγόνο (Ο) και φθόριο (F) είναι δύο καλά παραδείγματα. Κάθε ένα από αυτά τα στοιχεία αναζητά μερικά ηλεκτρόνια για να δημιουργήσει ένα γεμάτο κέλυφος. Το καθένα έχει ένα γεμάτο φλοιό με δύο ηλεκτρόνια, αλλά το δεύτερο κέλυφος τους θέλει να έχει οκτώ.
Συνιστάται:
Ποια είναι η δύναμη έλξης που συγκρατεί τα άτομα ή τα ιόντα μαζί;

Χημικοί δεσμοί
Ποια είναι τα κοινά πολυατομικά ιόντα;

Κοινά Πολυατομικά Ιόντα Zn2+ Ψευδάργυρος. Cd2+ Κάδμιο. 1+ χρέωση. NH4. Αμμώνιο. Hg2. Υδράργυρος (Ι) Ag+ Αργυρός. 1- χρέωση. C2H3O2. Οξικό άλας. CN- Κυανιούχο. ClO- Υποχλωριώδες. ClO2. Χλωρίτης. ClO3. Χλωρικό άλας. ClO4. Υπερχλωρικό. HCO3. Υδρογόνο (δι)ανθρακικό. H2PO4
Πώς συνδέετε πολυατομικά ιόντα;
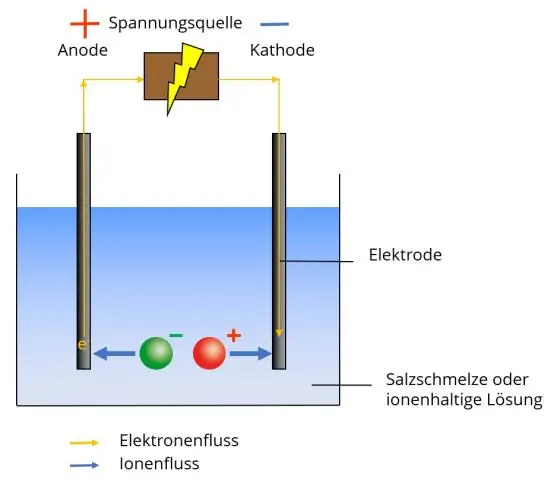
Ένα πολυατομικό ιόν έχει δύο ή περισσότερα ομοιοπολικά συνδεδεμένα άτομα που δρουν ως ένα μόνο ιόν. Το πολυατομικό ιόν σχηματίζει ιοντικούς δεσμούς με άλλα ιόντα και δρα εξωτερικά ως μονάδα, ακριβώς όπως τα μονοατομικά ιόντα
Χρησιμοποιείτε προθέματα όταν ονομάζετε πολυατομικά ιόντα;

Τα πολυατομικά ιόντα έχουν ειδικές ονομασίες. Πολλά από αυτά περιέχουν οξυγόνο και ονομάζονται οξυανιόντα. Όταν διαφορετικά οξυανιόντα αποτελούνται από το ίδιο στοιχείο, αλλά έχουν διαφορετικό αριθμό ατόμων οξυγόνου, τότε χρησιμοποιούνται προθέματα και επιθήματα για να τα ξεχωρίσουν
Ποιοι είναι οι τύποι των ατομικών δεσμών;

Υπάρχουν τρεις κύριοι τύποι χημικών δεσμών: ιονικοί, ομοιοπολικοί και μεταλλικοί. Οι ιοντικοί δεσμοί σχηματίζονται λόγω της μεταφοράς ενός ηλεκτρονίου από το ένα άτομο στο άλλο. Οι ομοιοπολικοί δεσμοί περιλαμβάνουν την κοινή χρήση ηλεκτρονίων μεταξύ δύο ατόμων
