
- Συγγραφέας Miles Stephen [email protected].
- Public 2023-12-15 23:35.
- Τελευταία τροποποίηση 2025-01-22 16:57.
Παρατηρήστε μια βασική διαφορά μεταξύ του γενικού διάγραμμα φάσης και το διάγραμμα φάσης Για νερό . Ο λόγος είναι ότι νερό είναι μια ασυνήθιστη ουσία στο ότι η στερεά της κατάσταση είναι λιγότερο πυκνή από την υγρή κατάσταση. Ο πάγος επιπλέει σε υγρό νερό . Επομένως, μια αλλαγή πίεσης έχει το αντίθετο αποτέλεσμα σε αυτά τα δύο φάσεις.
Σε τι διαφέρει λοιπόν το διάγραμμα φάσεων του νερού από τις υπόλοιπες ουσίες;
ο διάγραμμα φάσης για τους περισσότερους ουσίες μοιάζει με αυτό. Έτσι, η αρνητική κλίση δείχνει ότι το υγρό φάση έχει μεγαλύτερη πυκνότητα από το στερεό φάση . Με άλλα λόγια, η πυκνότητα του πάγου είναι μικρότερη από αυτή του νερό . Για τα περισσότερα άλλα κοινά ουσίες , το στερεό είναι πιο πυκνό από το υγρό.
Ομοίως, πώς διαφέρει το διάγραμμα φάσης για το νερό και το διοξείδιο του άνθρακα; Διαφορετικός διοξείδιο του άνθρακα και οι περισσότερες άλλες ουσίες, οι διάγραμμα φάσης του νερό δείχνει αρνητική κλίση για την οριακή γραμμή μεταξύ υγρής και στερεάς κατάστασης. Αυτό διαφορά πρέπει να κάνω με αυτό το γεγονός ότι νερό στην πραγματικότητα διαστέλλεται καθώς περνά από την υγρή κατάσταση στη στερεή κατάσταση.
ποιος είναι ο σκοπός ενός διαγράμματος φάσης;
ΕΝΑ διάγραμμα φάσης στη φυσική χημεία, τη μηχανική, την ορυκτολογία και την επιστήμη των υλικών είναι ένας τύπος γραφήματος που χρησιμοποιείται για να δείξει συνθήκες (πίεση, θερμοκρασία, όγκος κ.λπ.) στις οποίες διακρίνονται θερμοδυναμικά φάσεις (όπως στερεές, υγρές ή αέριες καταστάσεις) εμφανίζονται και συνυπάρχουν σε ισορροπία.
Γιατί τα διαγράμματα φάσεων είναι διαφορετικά για κάθε ουσία;
Κατά την αξιολόγηση των διάγραμμα φάσης , αξίζει να σημειωθεί ότι το στερεό-υγρό φάση όριο στο διάγραμμα φάσης από τα περισσότερα ουσίες έχει θετική κλίση. Αυτό οφείλεται στο στερεό φάση έχοντας μεγαλύτερη πυκνότητα από το υγρό, έτσι ώστε η αύξηση της πίεσης να αυξάνει τη θερμοκρασία τήξης.
Συνιστάται:
Γιατί είναι σημαντικός ο δεσμός υδρογόνου για τις ιδιότητες του νερού;

Οι δεσμοί υδρογόνου στο νερό παρέχουν πολλά χαρακτηριστικά πλεονεκτήματα στο νερό: συνοχή (κρατά μόρια νερού μαζί), υψηλή ειδική θερμότητα (απορρόφηση θερμότητας κατά τη θραύση, απελευθέρωση θερμότητας όταν σχηματίζεται, ελαχιστοποίηση της αλλαγής θερμοκρασίας), υψηλή θερμότητα εξάτμισης (πολλοί δεσμοί υδρογόνου πρέπει να σπάσουν για να εξατμιστεί το νερό)
Πώς μπορεί ο δεσμός υδρογόνου μεταξύ των μορίων του νερού να εξηγήσει την ικανότητα του νερού να απορροφά μεγάλες ποσότητες ενέργειας πριν από την εξάτμιση;

Οι δεσμοί υδρογόνου στο νερό του επιτρέπουν να απορροφά και να απελευθερώνει θερμική ενέργεια πιο αργά από πολλές άλλες ουσίες. Η θερμοκρασία είναι ένα μέτρο της κίνησης (κινητικής ενέργειας) των μορίων. Καθώς η κίνηση αυξάνεται, η ενέργεια είναι υψηλότερη και επομένως η θερμοκρασία είναι υψηλότερη
Γιατί η εξάτμιση του νερού είναι παράδειγμα φυσικής αλλαγής;

Η εξάτμιση του νερού είναι μια φυσική αλλαγή. Όταν το νερό εξατμίζεται, αλλάζει από υγρή σε αέρια κατάσταση, αλλά παραμένει νερό. δεν έχει μεταβληθεί σε καμία άλλη ουσία. Για παράδειγμα, η καύση του υδρογόνου στον αέρα υφίσταται μια χημική αλλαγή κατά την οποία μετατρέπεται σε νερό
Γιατί τα χρώματα φαίνονται διαφορετικά σε διαφορετικό φωτισμό;

Τα αντικείμενα εμφανίζονται διαφορετικά χρώματα επειδή απορροφούν ορισμένα χρώματα (μήκη κύματος) και ανακλώνται ή μεταδίδουν άλλα χρώματα. Για παράδειγμα, ένα κόκκινο πουκάμισο φαίνεται κόκκινο επειδή τα μόρια της βαφής στο ύφασμα έχουν απορροφήσει τα μήκη κύματος του φωτός από το βιολετί/μπλε άκρο του φάσματος
Γιατί είναι διαφορετικό το φάσμα απορρόφησης για τη χλωροφύλλη α και το φάσμα δράσης για τη φωτοσύνθεση;
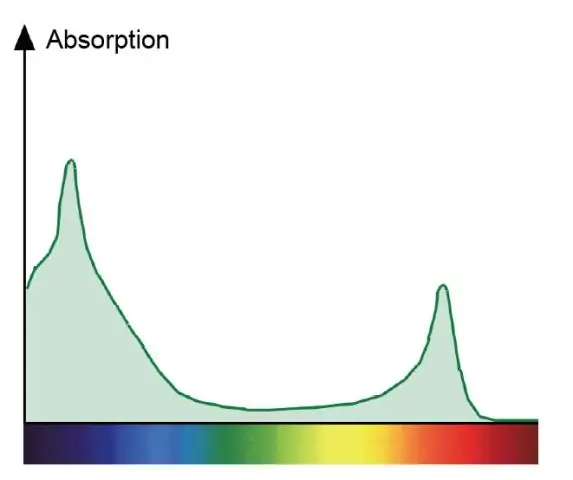
Ένα φάσμα απορρόφησης δείχνει όλα τα χρώματα του φωτός που απορροφάται από ένα φυτό. Ένα φάσμα δράσης δείχνει όλα τα χρώματα του φωτός που χρησιμοποιούνται στη φωτοσύνθεση. Οι χλωροφύλλες είναι οι πράσινες χρωστικές που απορροφούν το κόκκινο και το μπλε και συμμετέχουν άμεσα στη φωτοσύνθεση
