
- Συγγραφέας Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Τελευταία τροποποίηση 2025-01-22 16:57.
Οι ιοντικές ενώσεις έχουν υψηλά σημεία τήξης και βρασμού επειδή εκεί είναι ένα ισχυρή ηλεκτροστατική δύναμη έλξης μεταξύ των αντίθετα φορτισμένων ιόντων και ως εκ τούτου απαιτείται μεγάλη ποσότητα ενέργειας για να σπάσει η ισχυρή δύναμη σύνδεσης μεταξύ ιόντων.
Οι άνθρωποι ρωτούν επίσης, γιατί τα ιόντα έχουν υψηλά σημεία τήξης και βρασμού;
Σε ιωνικός ενώσεις, υπάρχει ισχυρή δύναμη έλξης μεταξύ των αντίθετα φορτισμένων ιόντων , επομένως απαιτείται μεγάλη ποσότητα ενέργειας για να σπάσει η ισχυρή δύναμη σύνδεσης μεταξύ των ιόντων . Γι' αυτό ιωνικός ενώσεις έχουν υψηλό σημείο τήξης και βρασμού.
Δεύτερον, ποια ιοντική ένωση έχει υψηλότερο σημείο τήξης; Γενικά, όσο μεγαλύτερο είναι το φορτίο, τόσο μεγαλύτερη είναι η ηλεκτροστατική έλξη, όσο ισχυρότερος είναι ο ιοντικός δεσμός, τόσο υψηλότερο είναι το σημείο τήξης. Ο παρακάτω πίνακας συγκρίνει το σημείο τήξης και τα φορτία ιόντων για δύο ιοντικές ενώσεις, το χλωριούχο νάτριο ( NaCl ) και οξείδιο του μαγνησίου (MgO).
Επιπλέον, οι ιοντικές ενώσεις έχουν υψηλά σημεία βρασμού;
Οι ιοντικές ενώσεις έχουν υψηλότερα σημεία βρασμού . Οι ελκτικές δυνάμεις μεταξύ ιόντων είναι πολύ ισχυρότερα από εκείνα μεταξύ ομοιοπολικών μορίων. Χρειάζονται περίπου 1000 έως 17 000 kJ/mol για τον διαχωρισμό του ιόντων σε ιοντικές ενώσεις.
Οι ομοιοπολικές ενώσεις έχουν υψηλά σημεία βρασμού;
Ομοιοπολικούς δεσμούς μεταξύ ατόμων είναι αρκετά ισχυρά, αλλά έλξεις μεταξύ μορίων/ ενώσεις ή διαμοριακές δυνάμεις, μπορώ να είναι σχετικά αδύναμος. Ομοιοπολικές ενώσεις γενικά έχω χαμηλός βρασμός και σημεία τήξης , και είναι βρέθηκαν και στις τρεις φυσικές καταστάσεις στο δωμάτιο θερμοκρασία.
Συνιστάται:
Ποια μη μεταλλικά έχουν υψηλό σημείο τήξης και βρασμού;

Το διαμάντι είναι αλλοτρόπο/μορφή άνθρακα. Έτσι, ο άνθρακας (σε μορφή διαμαντιού) είναι το μόνο μη μέταλλο που έχει πολύ υψηλό σημείο τήξης
Το νάτριο έχει υψηλό σημείο τήξης;

97,79 °C
Γιατί το νερό έχει υψηλό σημείο τήξης;
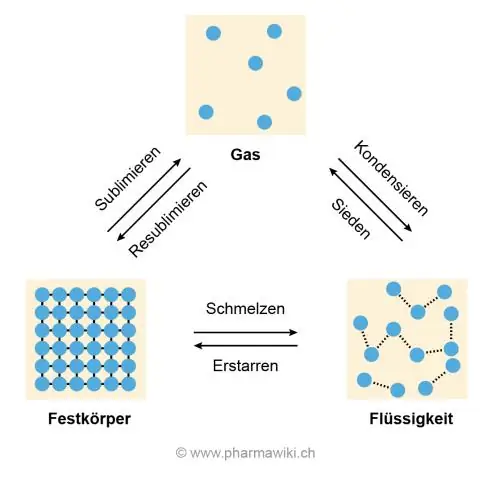
Ο λόγος για τις υψηλές θερμοκρασίες τήξης και βρασμού είναι ο δεσμός υδρογόνου μεταξύ των μορίων του νερού που τα αναγκάζει να κολλήσουν μεταξύ τους και να αντιστέκονται στην απομάκρυνση, κάτι που συμβαίνει όταν ο πάγος λιώνει και το νερό βράζει για να γίνει αέριο
Γιατί το νάτριο έχει υψηλό σημείο τήξης;

Το χλωριούχο νάτριο έχει υψηλό σημείο τήξης λόγω της ισχυρής ηλεκτροστατικής έλξης μεταξύ θετικών και αρνητικών ιόντων του. Αυτό απαιτεί περισσότερη θερμική ενέργεια για να ξεπεραστεί. Έχει επίσης μια γιγάντια δομή πλέγματος, που σημαίνει ότι περιέχει εκατομμύρια ισχυρούς ιοντικούς δεσμούς
Γιατί το νερό έχει υψηλό σημείο βρασμού και σημείο τήξης;

Ο λόγος για τις υψηλές θερμοκρασίες τήξης και βρασμού είναι ο δεσμός υδρογόνου μεταξύ των μορίων του νερού που τα αναγκάζει να κολλήσουν μεταξύ τους και να αντιστέκονται στην απομάκρυνση, κάτι που συμβαίνει όταν ο πάγος λιώνει και το νερό βράζει για να γίνει αέριο
