
- Συγγραφέας Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Τελευταία τροποποίηση 2025-01-22 16:57.
Σε αυτό το βίντεο θα εξισορροπήσουμε την εξίσωση KOH + H2SO4 = K2SO4 + H2O και να δώσετε τους σωστούς συντελεστές για κάθε ένωση. Για να εξισορροπηθεί KOH + H2SO4 = K2SO4 + H2O θα πρέπει να βεβαιωθείτε ότι έχετε μετρήσει όλα τα άτομα σε κάθε πλευρά του χημική εξίσωση.
Λαμβάνοντας υπόψη αυτό, ποια είναι η ισορροπημένη εξίσωση για h2so4 και Koh;
Εξισορροπητής χημικών εξισώσεων H2SO4 + KOH = K2SO4 + H2O.
Γνωρίζετε επίσης, ποια είναι η ισορροπημένη εξίσωση για το Koh h3po4; Χημική ουσία Εξίσωση Ισορροπητής ΚΟΗ + H3PO4 = K3PO4 + H2O.
Έχοντας αυτό υπόψη, ποια είναι τα προϊόντα μιας αντίδρασης εξουδετέρωσης μεταξύ h2so4 και Koh;
Αντίδραση εξουδετέρωσης . Δύο τυφλοπόντικες υδροξείδιο του καλίου , μια ισχυρή βάση, σε αντίδραση με ένα γραμμομόριο ισχυρού οξέος, θειικό οξύ , σχηματίζουν θειικό κάλιο και νερό. Ένα μόριο από ΚΟΗ αντιδρά με μισό mol H2SO4 H 2 S O 4.
Τι συμβαίνει όταν το θειικό οξύ αντιδρά με το υδροξείδιο του καλίου;
Το υδροξείδιο του καλίου αντιδρά με το θειικό οξύ σε μια διαδικασία που μπορεί να περιγραφεί από την εξίσωση: 2KOH + H2SO4 K2SO4 + 2 H2O Εάν 425 mL 0,440M H2SO4 αντιδρά με 450 mL 0,210M ΚΟΗ , ποια είναι η συγκέντρωση του H2SO4 που απομένει μετά το αντίδραση ειναι ΟΛΟΚΛΗΡΩΜΕΝΟ?
Συνιστάται:
Πώς ονομάζεται το άλας που σχηματίζεται από την εξουδετέρωση του υδροχλωρικού οξέος και του υδροξειδίου του νατρίου;
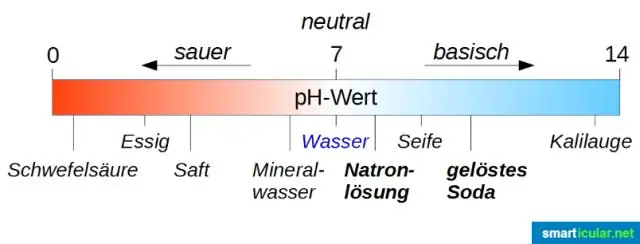
Εξήγηση: Η αντίδραση μεταξύ υδροξειδίου του νατρίου (NaOH) και υδροχλωρικού οξέος (HCl) είναι μια αντίδραση εξουδετέρωσης που έχει ως αποτέλεσμα το σχηματισμό άλατος, χλωριούχου νατρίου (NaCl) και νερού (H2O). Είναι μια εξώθερμη αντίδραση
Ποια είναι η ισορροπημένη εξίσωση για την αμμωνία και το θειικό οξύ;

Για να εξισορροπήσετε NH3 + H2SO4 = (NH4)2SO4, θα χρειαστεί να μετρήσετε όλα τα άτομα σε κάθε πλευρά της χημικής εξίσωσης
Ποια εξίσωση είναι κατάλληλη για τον υπολογισμό της θερμότητας που παράγεται από την αντίδραση HCl NaOH;
Υπολογίστε τον αριθμό των γραμμομορίων βάσης που προσθέτετε για να προσδιορίσετε τη γραμμομοριακή θερμότητα εξουδετέρωσης, που εκφράζεται χρησιμοποιώντας την εξίσωση ΔH = Q ÷ n, όπου 'n' είναι ο αριθμός των γραμμομορίων. Για παράδειγμα, ας υποθέσουμε ότι προσθέτετε 25 mL 1,0 M NaOH στο HCl σας για να παράγετε θερμότητα εξουδετέρωσης 447,78 Joules
Ποια είναι η ισορροπημένη εξίσωση για το μαγνήσιο και τον ατμό;

Πώς να εξισορροπήσετε Mg + H2O = MgO + H2 | Μαγνήσιο + Νερό (ατμός)
Ποια είναι η ισορροπημένη εξίσωση για το οξείδιο του χαλκού και το θειικό οξύ;

Για να εξισορροπήσετε CuO + H2SO4 = CuSO4 + H2O, θα χρειαστεί να βεβαιωθείτε ότι έχετε μετρήσει όλα τα άτομα σε κάθε πλευρά της χημικής εξίσωσης. Μόλις μάθετε πόσα από κάθε τύπο ατόμου μπορείτε να αλλάξετε μόνο τους συντελεστές (τους αριθμούς μπροστά από τα άτομα ή τις ενώσεις) για να εξισορροπήσετε την εξίσωση για οξείδιο χαλκού (II) + θειικό οξύ
