
- Συγγραφέας Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Τελευταία τροποποίηση 2025-06-01 05:04.
Συνεχίζοντας με το άζωτο , παρατηρούμε ότι στο (α) το άζωτο Το άτομο μοιράζεται τρία ζεύγη δεσμών και έχει ένα μοναχικό ζεύγος και έχει συνολικά 5 ηλεκτρόνια σθένους. ο επίσημη χρέωση στο άζωτο Το άτομο είναι επομένως 5 - (2 + 6/2) = 0. Στο (β), το άζωτο άτομο έχει α επίσημη χρέωση από -1.
Επίσης, ποιο είναι το επίσημο φορτίο του αζώτου;
Τα ηλεκτρόνια σθένους των άζωτο στις ενώσεις του είναι όλα sp³ υβριδισμένα τροχιακά. ο επίσημη χρέωση επί Ν είναι συνήθως -1 για ένα ανιόν, 0 για μια ουδέτερη ένωση και +1 σε κατιόντα. ΕΝΑ άζωτο άτομο με α επίσημη χρέωση -3 θα αντιστοιχεί σε ένα ιόν νιτριδίου, Ν3α, το οποίο είναι ισχυρά βασικό σε υδατικό διάλυμα.
Ομοίως, πώς υπολογίζετε την επίσημη χρέωση; Επίσημη χρέωση = [# ηλεκτρόνια σθένους σε ουδέτερο άτομο] - [(# μεμονωμένα ζεύγη ηλεκτρονίων) + (½ # ηλεκτρόνια σύνδεσης)] Ηλεκτρόνια σθένους = αντιστοιχεί στον αριθμό ομάδας του περιοδικού πίνακα (για αντιπροσωπευτικά στοιχεία). Lone Pairs = μόνα ηλεκτρόνια που κάθονται στο άτομο. Κάθε ηλεκτρόνιο μετράει ως ένα και έτσι ένα ζευγάρι μετράει ως δύο.
Επίσης, να γνωρίζουμε είναι, ποια είναι η επίσημη χρέωση αζώτου στην εικόνα που παρέχεται;
Κάντε κλικ σε ένα από τα δύο εικόνα για να δείτε τη βελτιστοποιημένη γεωμετρία. ο άζωτο άτομο έχει τέσσερις δεσμούς με το υδρογόνο, δίνοντας το άζωτο άτομο συνολικά 4 ηλεκτρόνια σθένους. Ατομικός άζωτο έχει 5 ηλεκτρόνια σθένους, και έτσι (5-4) = +1 και είναι σωστά χαρακτηρισμένο ως επίσημη χρέωση του +1.
Το οξυγόνο είναι θετικό ή αρνητικό;
Ένα καλό παράδειγμα είναι ένα άτομο οξυγόνου που μοιράζεται ένα ηλεκτρόνιο με καθένα από τα δύο κοντά άτομα υδρογόνου , φτιάχνοντας ένα μόριο νερού H2O. Ένα άτομο οξυγόνου που έχει δώσει επιτυχώς ένα ή δύο ηλεκτρόνια ή μοιράζεται ένα ή δύο ηλεκτρόνια έχει χάσει μέρος του αρνητικού του φορτίου, επομένως μένει θετικά φορτισμένο.
Συνιστάται:
Ποιο είναι το φορτίο του ιόντος υδρονίου;

Το ιόν υδρονίου έχει φορτίο +1. Έχει τον χημικό τύπο Η3Ο+. Τα ιόντα υδρονίου παράγονται όταν ένα οξύ αντιδρά με το νερό
Ποιο είναι το φορτίο ενός ατόμου που αποκτά ηλεκτρόνια;
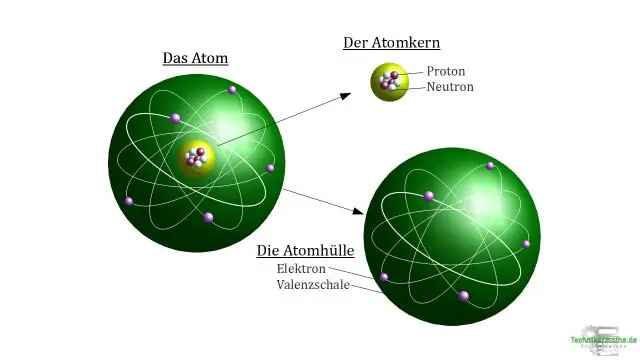
Ένα ιόν είναι ένα άτομο που έχει αποκτήσει ή χάσει ένα ή περισσότερα ηλεκτρόνια και επομένως έχει αρνητικό ή θετικό φορτίο. Ένα κατιόν είναι ένα άτομο που έχει χάσει ένα ηλεκτρόνιο σθένους και επομένως έχει περισσότερα θετικά πρωτόνια από αρνητικά ηλεκτρόνια, επομένως είναι θετικά φορτισμένο
Γιατί η ανατολική λευκή πεύκη είναι το επίσημο δέντρο του Οντάριο;

Η ανατολική λευκή πεύκη ονομάστηκε το επίσημο δέντρο του Οντάριο το 1984. Η όμορφη σιλουέτα του δέντρου έγινε διάσημη από μέλη του Group of Seven. Το μαλακό, χλωμό ξύλο και το τεράστιο μέγεθός του καθιέρωσαν την αξία του νωρίς στην ιστορία του Καναδά για προϊόντα που κυμαίνονται από έπιπλα μέχρι ιστούς πλοίων
Το ηλεκτρικό φορτίο είναι ιδιότητα μόνο του ηλεκτρισμού ή το φορτίο είναι ιδιότητα όλων των ατόμων;

Ένα θετικό φορτίο έλκει ένα αρνητικό φορτίο και απωθεί άλλα θετικά φορτία. Είναι το ηλεκτρικό φορτίο ιδιότητα μόνο του ηλεκτρισμού ή το φορτίο ιδιότητα όλων των ατόμων; Το ηλεκτρικό φορτίο είναι ιδιότητα όλων των ατόμων
Ποιο είναι το υπόστρωμα σε αυτή την αντίδραση;

Στη βιοχημεία, το υπόστρωμα είναι ένα μόριο πάνω στο οποίο δρα ένα ένζυμο. Τα ένζυμα καταλύουν χημικές αντιδράσεις που περιλαμβάνουν το(τα) υπόστρωμα(α). Στην περίπτωση ενός μόνο υποστρώματος, το υπόστρωμα συνδέεται με τη δραστική θέση του ενζύμου και σχηματίζεται ένα σύμπλεγμα ενζύμου-υποστρώματος
